Hoffnungsvolle Botschaft - mRNA-Therapeutika
Henrik Müller
(08.05.2020) Das menschliche Immunsystem zu überlisten und in eine Medikamentenfabrik zu verwandeln, ist eine heikle
Mission. Gelingen kann sie mit in vitro transkribierter mRNA, die als zelleigenes Botenmolekül getarnt die Proteinsynthese-Maschinerie kapert und humorale sowie zelluläre Immunreaktionen auslöst.
In vitro transkribierte mRNA (IVT-mRNA) gilt als Wirkstoff der Zukunft, der eine rasche Entwicklung und Hochskalierung von Produktionskapazitäten erlaubt. Nicht zuletzt deshalb schmiedete die Mainzer Biotech-Firma BioNTech mit dem US-Pharmakonzern Pfizer im April dieses Jahres eine Allianz, um so schnell wie möglich Millionen mRNA-basierter Impfstoffdosen gegen SARS-CoV-2 herzustellen.
Ugur Sahin, BioNTechs CEO, erklärt: „SARS-CoV-2 ist kein saisonaler Erreger. Innerhalb der Bevölkerung ist keine Immunität etabliert. Um wiederholt auftretende Epidemien zu vermeiden, ist eine umfassende Grundimmunisierung der Bevölkerung notwendig, für die wir in den nächsten 18 Monaten mehr als drei Milliarden Impfdosen benötigen.“
Mit herkömmlichen Vakzinen ist das nicht zu schaffen. Neben BioNTech arbeiten die deutschen Firmen CureVac und Ethris an mRNA-Therapeutika gegen virale und bakterielle Infektionen, verschiedene Krebsarten und erbliche Erkrankungen. Aber unabhängig davon, ob mRNA-Vakzine prophylaktisch oder therapeutisch eingesetzt werden sollen, wird ihre Entwicklung von zwei Fragen dominiert: Was verbessert ihre Pharmakokinetik und -dynamik? Und wie viel Aktivierung des Immunsystems ist für den gewünschten Effekt nötig und den Patienten zumutbar?
Bereits eine Codon-Optimierung kann die Immunantwort um mehrere Größenordnungen erhöhen, wie CureVacs Immunbiologen zeigten (Mol. Ther. 23(9): 1456-64).
Die Impfstoffhersteller sind aber schon viele Schritte weiter. So setzt BioNTech drei unterschiedliche mRNA-Plattformen ein.
Sahin erklärt: „Für die inflammatorische Adjuvansreaktion von mRNA sind Uridin-Nukleoside verantwortlich, die Toll-like-Rezeptoren auf der Oberfläche von Immunzellen oder in endosomalen Kompartimenten aktivieren. Wir nutzen sie, um besonders immunogene mRNA zu generieren und um die Immunreaktion in Richtung T-Zell-Antwort zu verschieben.“
Einerseits ist es von Vorteil, dass mRNA eine eingebaute Adjuvans-Funktion mitbringt. Andererseits führt dies aber auch zu Nebenwirkungen, die dosisabhängig sind. Wie RNA-Modifikationen das Immunsystem modulieren, fasst ein Review aus dem Labor von Alexander Dalpke am Dresdner Institut für Medizinische Mikrobiologie und Hygiene zusammen (Genes 10(2): E92).
Maskierte Uridine
BioNTechs zweite Plattform beschreibt Sahin so: „Wenn wir Uridine maskieren, verringern wir ihre Adjuvans-Funktion und somit die Aktivierung des angeborenen Immunsystems. Diese mRNAs können wir daher in höheren Dosen applizieren und mehr Antigen zur Verfügung stellen. Davon profitieren die B-Zellen des erworbenen Immunsystems. Wir erhalten besonders hohe Antikörpertiter.“
Was mit Maskierung gemeint ist, verrät Ethris CSO und Mitgründer Carsten Rudolph: „Wir ersetzen Uridin und Cytidin zum Beispiel durch 2-Thio-Uridin und 5-Methyl-Cytidin, die von Mustererkennungs-Rezeptoren übersehen werden. Entsprechend induziert weniger immunogene mRNA eine schwächere Immunantwort.“
Das angeborene Immunsystem zu aktivieren, ohne es zu sehr zu stimulieren und dem erworbenen Immunsystem gleichzeitig Antigene zur Verfügung zu stellen, ist ein weiterer Vorteil von mRNA-Vakzinen. Allerdings muss ihre Sequenz jeweils auf die sich wechselseitig beeinflussenden Aufgaben optimiert werden.
„Unsere dritte mRNA-Plattform hat eine Besonderheit“, erläutert Sahin. „Ihre mRNAs codieren einen zweiten offenen Leserahmen, nämlich eine Alphavirus-RNA-Replikase, die die nachgeschaltete Antigensequenz amplifiziert. Trotz sechzigfach geringerer Dosierung erreichen wir so schnell bis zu zehntausend mRNA-Kopien pro Zelle. Außerdem werden selbst-amplifizierende mRNAs bis zu vierzehn Tage translatiert, wodurch wir auf die Booster-Impfungen der zwei anderen Plattformen verzichten können.“
Im Gegenzug müssen RNA-Replicons aber ohne die meisten Nukleotid-Modifikationen auskommen und verlängern die zu internalisierende mRNA von drei auf zehn Kilobasen.
Das Design der synthetischen RNAs folgt hierbei dem natürlichen Bauplan eukaryotischer mRNA. Deren Halbwertszeit in der Zelle beträgt nur sieben Stunden, da sie früher oder später ihre schützende 5’-Cap und den 3‘-poly(A)-Schwanz verliert und von Exo- und Endonukleasen zerschnitten wird. Dem versuchen Impfstoffhersteller zugunsten einer ausgeprägten Immunantwort entgegenzuwirken. So modifizieren sie zum Beispiel mittels rekombinanter RNA-Guanylyltransferase das natürliche 7-Methyl-Guanosin-5‘-Cap ihrer IVT-mRNA, um deren Pharmakokinetik zu verbessern.
Vor allem modifizierte Anti-Reverse Cap-Analoga (ARCA) werden auf ihre translationalen Eigenschaften abgeklopft (Cell Cycle 17(13): 1624-36). Cap-Analoga mit Phospho-Thiolat- und Phospho-Thioat-Verknüpfungen anstelle der üblichen Phospho-Ester-Bindungen verstärken beispielsweise, je nach Position der Substitution, die Translationsinitiation oder verringern die Empfänglichkeit für Decapping-Enzyme und somit die Degradation durch Exonukleasen. (J. Am. Chem. Soc. 140 (18): 5987-99).
Auch der Status der 2‘-O-Methylierungen der Cap-Ribosen, anhand derer das Immunsystem zwischen „Selbst“ und „Fremd“ unterscheidet, prägt die immunstimulierende Aktivität synthetischer mRNA.
Feinjustierte Expression
Der 3‘-poly(A)-Schwanz wiederum beeinflusst die Expressionsrate der mRNA, indem er über poly(A)-bindende Proteine mit dem Translations-Initiationsfaktor eIF4E am 5‘-Cap interagiert – zumindest wenn er lang genug ist. Entsprechend lässt sich die Proteinexpression anhand der poly(A)-Länge feinjustieren, wie eine Arbeitsgruppe um Carsten Rudolph an der Kinderklinik der Ludwig-Maximilians-Universität München herausfand (Nat. Biotechnol. 29(2): 154-7).
Wie der poly(A)-Schwanz darüber hinaus synergistisch ein 5‘-Decapping verhindert, beschreibt ein Review von John Gross und seinen Kollegen von der University of California, San Francisco (Nat. Struct. Mol. Biol. 25: 1077-85).
Stabilität und subzelluläre Lokalisation einer mRNA bestimmen darüber hinaus Adenylat- und Uridylat-reiche Elemente (ARE) in ihrer 3‘-untranslatierten Region (UTR). Um ihre Halbwertszeit zu vervielfachen, kann zum Beispiel die 3‘-UTR humanen α- und β-Globins eingebaut werden (J. Med. Biotechnol. 11: 112-17). Falls eine mRNA das Immunsystem dagegen zu sehr stimuliert, können mehr 3‘-UTR-AREs eingeführt werden. Ähnliches gilt für 5‘-UTRs.
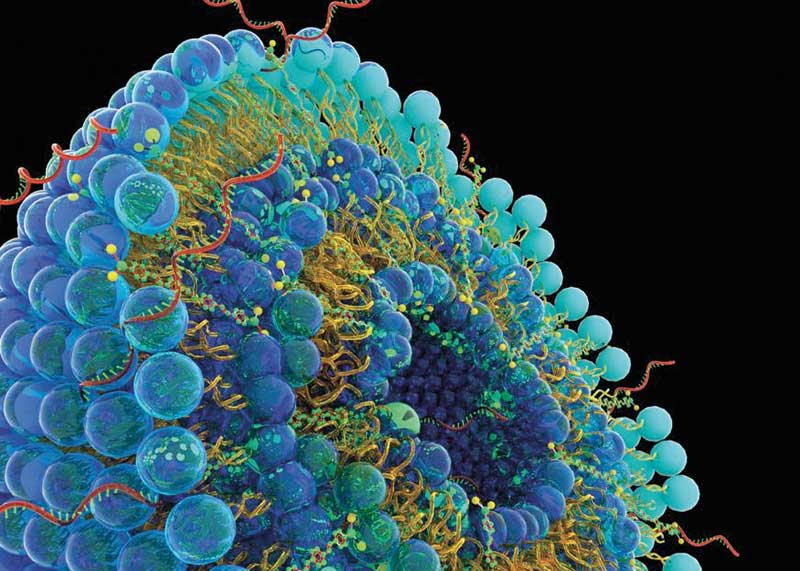
Nackte mRNA ist aber ein leichtes Opfer für Ribonukleasen. Hinzu kommt, dass sie Zellmembranen aufgrund ihres hohen Molekulargewichts von Tausenden Kilodalton und der hohen negativen Ladungsdichte nur schwer überwindet. Gleichzeitig ist sie aber klein genug, um von mononukleären Phagozyten in Leber, Niere und Milz herausgefischt zu werden. Kurzum, mRNA-Impfstoffe benötigen eine Schutzhülle.
Zelltransfer über Umwege
Die meisten klinischen mRNA-Studien umgehen diese Problematik, indem die Forscher die mRNA ex vivo etwa in dendritische oder T-Zellen via Elektroporation einschleusen und diese dann den Empfängern injizieren. Dieser adoptive Zelltransfer ist jedoch mühsam, und schlecht zu skalieren.
Alternative Übertragungssysteme wie virale Vektoren haben ebenfalls gravierende Nachteile: Sie können eine Immunantwort auslösen oder wiedererwecken, cytopathogene Effekte mit sich bringen sowie ins Empfängergenom integriert werden.
BioNTech, CureVac und Ethris setzen deshalb auf Lipid-basierte Nanopartikel (LNP) als nicht-virale Vektoren. Diese bestehen häufig aus mehreren Komponenten unterschiedlicher Konzentration: Etwa kationischen oder ionisierbaren Lipiden, die mit ihren tertiären oder quartären Aminen die polyanionische mRNA ummanteln. Diese werden mit zwitterionischen Lipiden ergänzt, die Phospholipide der Zellmembran nachahmen, sowie Cholesterol, das die Lipiddoppelschicht des Nanopartikels stabilisiert. Polyethylenglykol (PEG)-modifizierte Lipide ermöglichen schließlich eine Hydrathülle und erhöhen die Löslichkeit der LNPs.
Einen besonders eleganten Weg, mRNA zu verabreichen, beschreitet Ethris als eine von nur zwei Firmen weltweit.
Ethris CSO Carsten Rudolph erläutert: „Wir vernebeln Lipid- und Lipidoid-Nanopartikel, die auf bestimmten Oligoalkylamin-Motiven basieren, mit einem Inhalator und erreichen mit dem Aerosol bereits bei einmaliger Verabreichung etwa zehn Prozent aller Atemwegs-Epithelzellen (Angew. Chem. Int. Ed. Engl. 55(33): 9591-5).
Im Fall von SARS-CoV-2 codiert die inhalierte mRNA einen Antikörper gegen das Spike-Protein des Virus, der von der Lunge an allen Eintrittspforten des Virus translatiert wird. Die Nukleotidsequenz isoliert unser Kooperationspartner Neurimmune AG aus genesenen Patienten. Unsere Berechnungen dieser In-situ-Produktion zeigen, dass wir mit der resultierenden Konzentration Patienten-spezifischer Antikörper um zwei bis drei Größenordnungen höher liegen als zur therapeutischen Behandlung von COVID-19 nötig ist. Ab dem vierten Quartal 2020 werden wir das in klinischen Studien überprüfen.“
Wie gut das Konzept bereits im Mausmodell funktioniert, beschreibt Rudolph zusammen mit dem Lungenspezialisten Josef Rosenecker, aus dessen Arbeitsgruppe Ethris hervorgegangen ist (Nat. Nanotechnol. doi: 10.1038/s41565-018-0358-x).
Der Mechanismus, mit dem die verkapselte mRNA ins Zellinnere gelangt, ist nicht abschließend geklärt. Entweder werden die LNPs über Clathrin-vermittelte Endozytose internalisiert oder fusionieren mit Zellmembranen durch invertierte Phasentrennung. Spezifische Zielzellen können mittels funktionalisierter Oberflächenliganden, etwa monoklonale Antikörper oder Zuckerkonjugate, aber selektiv ausgewählt werden. Zusätzlich gelang es Sahins Team 2016, gezielt dendritische Zellen und Makrophagen nach intravenöser Verabreichung von mRNA-LNPs anzusprechen, indem die Forscher die Oberflächenladung der Nanopartikel justierten (Nature 14: 287-97).
Ohne Nebenwirkungen funktioniert das aber nicht. So induzieren kationische Liposomen über Toll-like-Rezeptoren inflammatorische Cytokine. Auch entkommen LNPs mit ihren ein- bis dreihundert Nanometern Durchmesser weder den phagozytotischen Kupfferzellen der Leber, noch entwischen sie aus den Lungenkapillaren – sie können also lokal toxische Effekte ausüben.
Welche intravenöse LNP-Dosis Patienten tolerieren, evaluiert BioNTech bis Frühjahr 2022 in einer klinischen Phase-I-Studie eines Melanoma-Vakzins.
Protamin-mRNA-Komplexe, wie beispielsweise CureVacs RNActive-Plattform, und Zell-penetrierende Peptide sind alternative Verabreichungsformen. Einen Überblick über aktuelle klinische mRNA-Studien, ihre Verabreichungsrouten und -vektoren findet man in einem Review von Daniel Anderson vom Massachusetts Institute of Technology und seinen Kollegen (Mol. Ther. 27(4): 710-28 , Tabelle 2).
Sprung nach vorn
Aktuell führt natürlich nichts an der Aufmerksamkeit für SARS-CoV-2-Impfstoffe vorbei. Ugur Sahin benennt deren positive Seite: „Die klinische Entwicklung von mRNA-Vakzinen macht durch COVID-19 einen gewaltigen Sprung nach vorn. Parallel dazu mahnt uns die Pandemie, unsere Herstellungskapazitäten für Impfstoffe auszubauen.“
Die drei deutschen Hersteller mRNA-basierter Impfstoffe und Therapeutika führen bereits erste klinische Studien im Kampf gegen COVID-19 durch oder wollen noch dieses Jahr damit beginnen.
Letzte Änderungen: 08.05.2020