Mit impressionistischen Flecken zu scharfen Bildern - Random Illumination Mikroskopie
Karin Hollricher
(06.04.2020) Die neue Random Illumination Microscopy erreicht eine doppelt so hohe Auflösung wie die konfokale Lichtmikroskopie und ist dabei so schnell und unkompliziert, dass sie sich für das 3D-Live-Cell-Imaging eignet.
Ein Mikroskop soll möglichst hoch aufgelöste Bilder erzeugen. Optische Bauteile und die Gesetze der Physik setzen diesem Begehr allerdings ziemlich scharfe Grenzen. Egal, ob man nun das Ernst-Abbé-Limit, das Rayleigh-Kriterium oder die Halbwertsbreite der Punktspreizfunktion heranzieht, um die Auflösung eines optischen Systems zu berechnen: Lichtmikroskope können, grob gesagt, eine xy-Auflösung von maximal der halben Wellenlänge des eingestrahlten Lichts erreichen. In der z-Achse ist die Auflösung zwei- bis dreimal schlechter, konfokale Geräte schaffen rund 800 Nanometer. Wichtig ist auch der Öffnungswinkel des Objektivs – je größer, desto besser.
Die Auflösung mit der Structured Illumination Microscopy (SIM) ist um den Faktor zwei besser als Ernst Abbés physikalische Grenze.Die beste SIM-Auflösung liegt bei 120 Nanometer transversal, also in der xy-Ebene. Axial, entlang der z-Achse, werden immerhin noch 360 Nanometer erreicht.
Forscher in Marseille entwickelten jedoch eine Technik, die ihren Angaben zufolge eine gleich hohe Auflösung wie SIM liefert, aber erheblich schneller und einfacher durchzuführen ist. Wegen ihrer Geschwindigkeit eignet sich diese Methode für das Live Cell Imaging in drei Dimensionen (bioRxiv doi: 10.1101/2020.01.27.905083).
Entscheidende Vorteile
Random Illumination Microscopy (RIM) tauften Anne Sentenac vom Institut Fresnel in Marseille und ihre Kollegen ihre Erfindung. „Die wichtigen Eigenschaften von RIM sind tiefes Eindringen in die Proben, höhere Geschwindigkeit als SIM und keine Toxizität, weil man mit wenig Laserleistung auskommt“, sagt die Physikerin Sentenac. „Andererseits müssen wir die Beleuchtung nicht exakt kontrollieren wie bei SIM.“
Dass RIM schnell und gut funktioniert, demonstrierten die französischen Forscher an verschiedenen biologischen Proben, von fixierten, transparenten Zellen bis zu lebenden Drosophila-Larven und -Puppen sowie C.-elegans-Larven. Somit kann man sich die Eigenschaften des Geräts, im wahrsten Sinne des Wortes, vor Augen halten. „Es gibt ja etliche Technologien, die mit einem Proof of Principle vorgestellt wurden. Wir Biologen mussten dann austesten, für welche Zwecke die jeweilige Technologie überhaupt taugt. Aber in diesem Fall werden wirklich beeindruckend viele Beispiele vorgestellt“, lobt Ulrike Engel, Direktorin des Nikon Imaging Center der Universität Heidelberg. In ihrer Abteilung wird auch ein SIM eingesetzt. Also weiß sie um die Vor- und Nachteile solcher Geräte.
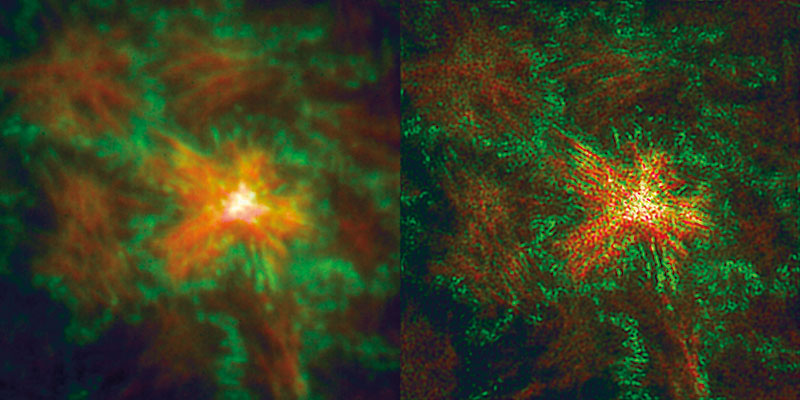
Bei der Abbildung kalibrierter DNA-Nanolineale zeigte sich das RIM auf Augenhöhe mit dem Zeiss-SIM-Elyra-System. Mit beiden Geräten ließen sich drei linear aneinander gekoppelte Fluorophor-Punkte (rot, grün und rot) auflösen, die jeweils 70 Nanometer voneinander entfernt waren. Es wurde jeweils ein Objektiv mit einem recht hohen Öffnungswinkel (Numerische Apertur: 1,49) verwendet, womit sich die äußeren roten Farbstoffe deutlich voneinander getrennt abbilden ließen.
In weniger als zehn Minuten könne man von solch einfachen Proben Bilder erhalten, selbst in zwei Farben, weil das experimentelle Protokoll so simpel sei, schreiben die Autoren. Von dem Moment, als sie den Objektträger einspannten, bis zum Ende der Rekonstruktion des Bildes hätten sie zehn Minuten mit RIM benötigt – im Gegensatz zu zwei Stunden mit SIM.
Zwar ist RIM nicht so hoch auflösend wie die Nanoskopie-Techniken dSTORM (Direct Stochastic Optical Reconstruction Microscopy) oder PALM (Photoactivation Localization Microscopy), dafür kommt sie aber mit viel weniger Licht aus, was die Forscher am Beispiel von Makrophagen demonstrierten.
Für das im bioRxiv-Paper gezeigte dSTORM-Bild benötigten sie 10.000 Aufnahmen, 300 Sekunden und zehn kW/cm2Laserleistung. Das RIM-Bild rekonstruierten sie hingegen aus 800 Bildern, die sie in 1,6 Sekunden aufgenommen hatten und für die sie nur 0,8 kW/cm2 Laserleistung benötigten – RIM ist in diesem Fall also 150-mal schneller und erfordert 12,5-mal weniger Strahlungsenergie, wodurch die Probe doppelt geschont wird.
Die Forscher betonen besonders, dass RIM auch einige Zellschichten tief im lebenden Gewebe funktioniert – im Gegensatz zu SIM. Sowohl von fixierten Proben wie auch lebenden Organismen fertigten sie dreidimensionale Bilder an: Sie mikroskopierten hierzu das Vimentin-Netzwerk fixierter HUVEC (Human umbilical vein endothelial)-Zellen und erstellten Filme aus zeitlich aufgelösten Bildserien aus dem bewegten Leben von Makrophagen-Podosomen.
Überzeugende Bilder
„Recht beeindruckend“ findet Engel ein 3D-Bild aus dem Notum lebender Drosophila-Puppen. Die Forscher hatten ein Übersichts-RIM-Bild des Myosin-II-Netzwerks erstellt und seine Dynamik als Film festgehalten. Als „beachtlich“ bezeichnet sie die Darstellung von Spaghetti Squash, der leichten Kette des Myosin II, das die Forscher aus den Tiefen eines sich entwickelnden Drosophila-Beines gewinnen konnten.
Weniger begeistert ist Engel allerdings von Abbildungen der Mikrovilli im Darm von C.-elegans-Larven. „Der gezeigte Intensitätskontrast erscheint mir zu gering. Tief im stark lichtbrechenden Gewebe funktioniert die Methode also vielleicht doch nicht so gut wie unmittelbar an der Oberfläche.“ Trotz dieses Kritikpunkts hält die Mikroskopie-Expertin die neue Random Illumination Microscopy für sehr spannend und durchaus vielversprechend.
Bei der Structured Illumination Microscopy wird das Objekt nicht homogen beleuchtet, das Licht fällt vielmehr zunächst auf ein Gitter. Dieses erzeugt ein Interferenzmuster, mit dem das Objekt beleuchtet wird. Es versteht sich, dass man aus nur einer Aufnahme kein Bild generieren kann. Dafür muss man mehrere mit jeweils unterschiedlich positionierten Gittern machen. Da man die Positionen der Gitter auf den jeweiligen Abbildungen kennt, kann man aus den gesammelten Aufnahmen ein Objektbild rekonstruieren. Allerdings muss die Position der Gitter sehr exakt definiert und eingestellt sein, sonst kommt am Ende der mathematischen Berechnungen nur Murks heraus.
RIM hingegen verzichtet auf die Gitter. Ein Interferenzmuster erzeugt jeder Laser ganz von alleine, wenn sein Licht auf eine unebene Fläche fällt. Dieses sogenannte Speckle-Muster besteht aus hellen und dunklen Flecken und Punkten. Speckles sind in der Mikroskopie ziemlich unerwünscht, die französischen Wissenschaftler nutzen sie jedoch zur Verbesserung der Bildgebung.
Um hoch aufgelöste RIM-Abbildungen aus weniger aufgelösten Aufnahmen zu rekonstruieren, sind hunderte Bilder mit jeweils unterschiedlichen, statistisch völlig zufälligen Speckle-Mustern nötig. Technisch ist RIM nicht besonders aufwendig, meint Sentenac. Für ihre Studie hätte ihr Team ein relativ simples Weitfeld-Fluoreszenzmikroskop verwendet. Um Speckles zu erzeugen, setzten die Forscher einen Lichtmodulator in den Strahlengang, der bis zu 500 unterschiedliche Speckle-Muster pro Sekunde erzeugen kann.
Punkt-für-Punkt
Je mehr Speckle-Bilder in die Rekonstruktion eingehen, desto homogener wird das Bild der Probe. An den Positionen der hellen Speckles – hier addieren sich die Lichtwellen durch Interferenz – werden die Fluorophore der Probe angeregt. Es entsteht ein quasi-pointillistisches Bild, Punkt-um-Punkt, ähnlich wie bei der höchstauflösenden dSTORM-Mikroskopie. Bei letzterer wird nur eines von mehreren dicht aneinanderliegenden Fluorophoren aufgenommen, während RIM alle Fluorophorpunkte innerhalb der hellen Speckles abbildet. Auf diese Weise arbeitet RIM viel schneller als dSTORM, löst die Objekte aber auch weniger gut auf.
Um aus den vielen Speckle-Bildern eine Abbildung des Objekts zu rekonstruieren, entwickelten die Forscher einen speziellen Algorithmus namens AlgoRIM. „Das ist eigentlich einfache Mathematik, aber die kann ich Ihnen trotzdem nicht mit einfachen Worten erklären“, sagt Sentenac. Okay, wer’s genau wissen will, kann das in den Vorarbeiten von Labouesse et al. (IEEE Trans. Comput. Process. 26: 2480) oder Idier et al. (IEEE Trans. Comput. Imaging 4: 87) nachlesen.
Sentenac meint, sie sei schon recht zufrieden mit der Entwicklung, aber es ginge noch besser. „Wir wollen beispielsweise schnellere Kameras ausprobieren, die die Pixel schneller auslesen können als diejenigen, die wir bisher verwendet haben. Und wir sind ja erst am Anfang.“
Letzte Änderungen: 06.04.2020