Der kleine Unterschied
(23.02.2023) Modifiziert oder unmodifiziert, das war lange die Frage unter mRNA-Vakzin-Entwicklern wie Curevac. Die Antwort hat sich die Firma nun selbst gegeben.
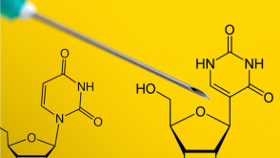
Adenosin, Cytidin, Guanosin und Uridin – das sind die bekannten Nucleoside einer RNA. Jahrzehntelang haben Forscher bis ins kleinste Detail untersucht, welche Aufgaben die Ribonukleinsäure erfüllt, wie sie synthetisiert und dann wieder abgebaut wird usw. Bereits Ende der 1960er-Jahre kam aber auch die Idee auf, RNA therapeutisch einzusetzen. Zunächst in doppelsträngiger Form zur Behandlung von Tumoren. Anfang der Neunziger dann der Geistesblitz: RNA und insbesondere mRNA könnte auch ein wunderbares Vakzin abgeben (Eur J Immunol, 23(7):1719-22). So ein Vakzin könnte recht kurzfristig und in großer Menge produziert werden, die ganze Translationsarbeit übernimmt der geimpfte Organismus selbst und im Vergleich zu damals ebenfalls entwickelten DNA-Vakzinen bestünde keine Gefahr der Integration ins Genom.
Auch an der Uni Tübingen hatte man das Potenzial von RNA-basierten Vakzinen erkannt. Im Januar 2000 veröffentlichten Ingmar Hoerr, Reinhard Obst, Hans-Georg Rammensee und Günter Jung ein folgenreiches Paper: „In vivo application of RNA leads to induction of specific cytotoxic T lymphocytes and antibodies“ (Eur J Immunol, 30(1):1-7). Einen Monat später, im Februar, gründeten drei von ihnen – Hoerr, Rammensee und Jung – die Firma Curevac.
Auffällige tRNA
Natürlich waren die Tübinger nicht die einzigen mit dieser Idee. Alle hatten aber mit denselben Problemen zu kämpfen. RNA ist nicht sehr stabil und versetzt das Immunsystem auch etwas zu sehr in Aufruhr. Was insbesondere bei der Verwendung als Impfstoff nicht unbedingt vorteilhaft ist.
Unterdessen machten in Pennsylvania Katalin Kariko und Drew Weissman Anfang der 2000er-Jahre interessante Beobachtungen. „Das Auffälligste war, dass tRNAs dendritische Zellen überhaupt nicht aktivieren. Und fast 25 % der Nucleoside in tRNA sind modifiziert. Das brachte uns auf die Idee auszuprobieren, ob wir die Entzündung loswerden, wenn wir modifizierte Nucleoside verwenden“, erinnert sich Weissman in einem Interview mit FEBS Letters 2021.
Diese RNA-Modifikationen passieren posttranskriptionell, sie kommen an quasi allen RNA-Formen vor und können alle Basen betreffen: etwa als Methyladenosin, Methylcytidin oder als das am häufigsten vorkommende Pseudouridin. Bei Letzterem wird nicht einfach nur eine Methylgruppe angehängt, es kommt zu tiefgreifenden Veränderungen am Nucleosid. Zunächst wird die Bindung zwischen der Base und der Ribose getrennt, dann rotiert das Uracil-Molekül um 180 Grad (um die N3–C6-Achse) und bildet anschließend eine neue Bindung zum Zucker aus. Durch diese Drehung ist die Base nicht mehr über ihr Stickstoff-Atom mit dem Ribose-Kohlenstoff verbunden, sondern es kommt zu einer C-C-Verbindung. Pseudouridylierung nennt sich dieser Prozess, an dem unter anderem die Pseudouridin-Synthasen (PUS) beteiligt sind.
Stabiler und effizienter
Durch diese Basen-Drehung werden neue Bindungen möglich, was insgesamt RNA-RNA- und RNA-Protein-Interaktionen verstärkt. Die Veränderungen wirken sich auch direkt auf die Stabilität der RNA und damit auch die Translationseffizienz aus. Interessant: Fällt die Pseudouridylierung aus, kann das fatale Folgen haben. Ein nicht korrekt funktionierendes PUS7-Enzym etwa ist verantwortlich für kognitive Einschränkungen, Mikrocephalie und aggressives Verhalten bei betroffenen Menschen (FEBS Lett, 595(18): 2310–2322 & AJHG, 103(6):1045-52).
Außerdem, und das konnten Kariko und Weissman letzlich 2005 zeigen, ist modifizierte RNA tatsächlich weitaus weniger „hyperimmunogen“ als unmodifzierte. „We show that RNA signals through human TLR3, TLR7, and TLR8, but incorporation of modified nucleosides [methylcytidine, methyladenosine, methyluridine, thiouridine or pseudouridine] ablates activity. Dendritic cells (DCs) exposed to such modified RNA express significantly less cytokines and activation markers than those treated with unmodified RNA“. Nur Pseudouridin-modifizierte RNA konnte das allerdings auch in primären dendritischen Zellen (Immunity, 23(2):165-75). Für Kariko und Weissman war die Sache klar, nur modifizierte, am besten mit Pseudouridin-modifizierte, RNA war als Impfstoff-Basis geeignet. Sie war stabil, effizient und brachte das Immunsystem nicht unnötig durcheinander.
Optimierte Sequenz
Curevac löste die Probleme mit der firmeneigenen RNActive-Technologie. Stabilität sollte das Nucleotid-bindende Peptid Protamin garantieren. Den immunstimulierenden Effekt einer unmodifizierten RNA wollte man hingegen nutzen, denn dann, so der Hintergedanke, könnte man auf ein zusätzliches Adjuvants verzichten. In Tübingen setzte man daher auf Optimierung der mRNA-Sequenz selbst, an der so lange Basen ausgetauscht werden (ohne dabei die Aminosäure-Sequenz zu beeinflussen), bis die Proteinexpression in gewünschtem Maße verläuft.
Jahrelang bildete diese Technologie die Grundlage von Curevacs Vakzin-Pipeline, etwa von CVSQIV, dem Grippe-Impfstoff-Kandidaten, oder CV7202, dem Vakzin-Kandidaten gegen Tollwut. Dann kam Corona. Und das so vielversprechende Konzept geriet ins Wanken. Der erste Impfstoff-Kandidat CVnCoV blieb, was die Effektivität anging, hinter den hohen Erwartungen zurück. Man zog schließlich die Reißleine und den Zulassungsantrag an die EMA zurück. Auch der zweite Versuch mit CV2CoV, mit weiteren Optimierungen in nicht-codierenden Regionen, brachte nicht die erhofften Ergebnisse.
Alle guten Dinge sind drei
Bereits Mitte 2021 muss daher der Entschluss gereift sein – vielleicht auch auf Anraten des Kooperationspartners GSK – es doch mal mit modifizierter RNA zu probieren. „Neben der Entwicklung dieser nicht-modifizierten mRNA-Technologie der zweiten Generation haben wir im Rahmen unserer Zusammenarbeit auch mit der Entwicklung modifizierter mRNA-Technologien begonnen“, heißt es schließlich offiziell in einer Pressemitteilung von Oktober 2021. Das Resultat dieser Neuausrichtung ist Curevacs Corona-Versuch Nummer drei: CV0501 mit modifizierter mRNA.
Diesen und den unmodifizierten CV2CoV hat die Firma in einer klinischen Studie auch gegeneinander antreten lassen. In einer Pressekonferenz im Januar verkündeten die Tübinger die recht eindeutigen Ergebnisse. „The second generation modified construct, CV0501, was shown to be well-tolerated within a much broader applicable dose range, compared to the unmodified second-generation mRNA backbone construct. Overall, the use of modified mRNA in CV0501 enabled a better reactogenicity profile, which was accompanied by stronger immunogenicity“, sagte Ulrike Gnad-Vogt, die damalige Leiterin der Entwicklungsabteilung.
Nur noch modifizierte mRNA
Auch der neu entwickelte Grippe-Impfstoff Flu-SV-mRNA mit modifizierter RNA schnitt gut ab, sogar besser als bereits zugelassene Konkurrenzprodukte im Vergleich. Firmenchef Franz-Werner Haas musste anerkennen, dass modifizierte mRNA „the best performing technology“ für prophylaktische Impfstoffe ist. „Correspondingly, we will enter the next stages of clinical development with modified candidates in COVID-19, as well as in flu.“
Auch ein anderer Verfechter des „unmodifizierten“ Ansatzes, die US-amerikanische Translate Bio, hat aufgegeben. Zumindest hat deren neuer Besitzer Sanofi die Entwicklung eingestellt – oder wie es aus der Firmenzentrale heißt: „ […] we’re taking [the mRNA platform] to the next level in development, including moving to modified mRNA …“.
Das Urteil über modifiziert vs unmodifziert ist also gesprochen. Zumindest was die Impfstoff-Entwicklung angeht, bei der Behandlung von Krebs sieht die Situation schon wieder ganz anders aus.
Kathleen Gransalke
Bild: gemeinfrei & Pixabay/Sergei-Grin (Spritze)
Weitere Artikel aus der Biotech-Welt
- Meer schwappt über in die Medizin
Algen, Quallen und Krebse produzieren medizinisch interessante Substanzen. Das küstennahe Bündnis BlueHealthTech möchte sie nutzbar machen.
- Die letzte Bastion
Im österreichischen Kundl produziert das letzte europäische Werk Penicillin – und zwar für die ganze Union. Doch wie lange noch?
- Nomen est Omen
LAB282 oder beLAB2122 klingt als Projektname sehr kryptisch. Hinter den Zahlen und Buchstaben verbirgt sich aber eine verbindende Geschichte.
Letzte Änderungen: 23.02.2023