Tipp 238: Western Blot mit PIA-PINK-Sekundärantikörpern
(07.02.2022) Bei den üblichen Western-Blot-Protokollen ist man mehr mit dem Waschen der Blot-Membran beschäftigt als mit dem eigentlichen Nachweis. Mit rosafarbenen, Goldnanopartikel-konjugierten Sekundärantikörpern kann man sich die vielen Waschschritte sparen und erhält dennoch saubere und gut quantifizierbare Proteinbanden.
Wer in einem proteinbiologischen Labor arbeitet, kennt die mühseligen Wasch- und Inkubationsschritte, die in der klassischen Immunfärbung nötig sind. Viel Arbeit, viele Stunden Warten und dann das Hoffen und Bangen, einen gleichmäßigen und fleckenfreien Nachweis zu erhalten, der für weitere Experimente oder eine Publikation geeignet ist.
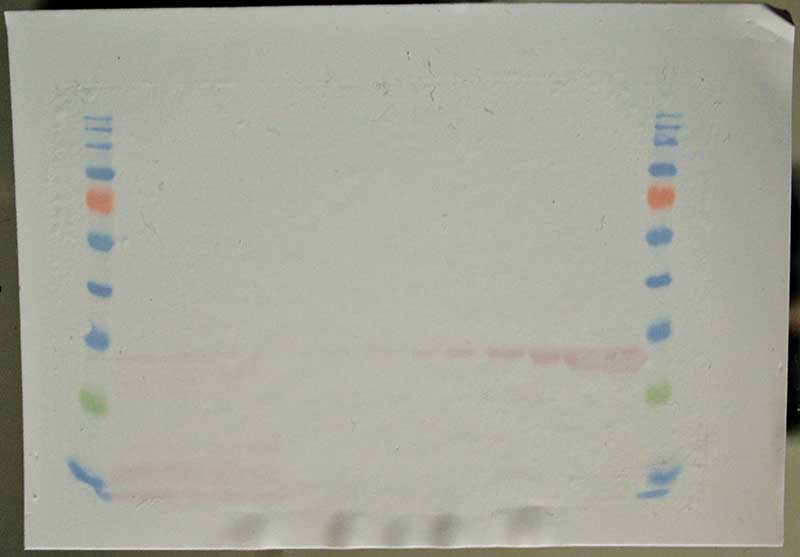
Den Zeitaufwand kann man mit Sekundärantikörpern meines Hamburger Start-ups PiNa-Tec verkürzen, die mit Goldnanopartikeln konjugiert sind. Mit diesen entfallen die meisten Arbeitsschritte, und gleichzeitig sind die verbleibenden Schritte schneller durchzuführen. Nötig sind nur noch ein fünfminütiger Blockierungsschritt sowie eine Inkubation von etwa einer Stunde. Das Ergebnis ist eine gut sichtbare, rote Färbung des Zielproteins (siehe Abbildung unten).
Pinkfarbene Antikörper
Das Verfahren wird als Partikel-Immuno-Assay oder kurz PIA bezeichnet. Aufgrund der pinken Farbe der verwendeten Goldnanopartikel heißen die PiNa-Tec-Reagenzien PIA-PINK. PIA-PINK ist ein Konjugat aus Sekundärantikörper und Goldnanopartikeln in gebrauchsfertiger Lösung. Der Anwender setzt nur den spezifischen Erstantikörper zu. Das Konjugat verbindet sich mit dem Erstantikörper und bindet an das nachzuweisende Protein. Auf diese Weise lassen sich Blot-Membranen in einem kombinierten Inkubationsschritt sauber und einfach färben.
Dazu werden die Proteine zunächst auf eine Nitrocellulose- oder Polyvinylidenfluorid(PVDF)-Membran übertragen (Western Blot oder Dot Blot). Die Membran wird danach in eine saubere Schale transferiert und fünf Minuten mit der PIA-PINK-Block-Lösung gewaschen. Für weniger kritische Blots kann auch BSA-TBS-Triton oder BSA-PBS-Triton als Waschlösung verwendet werden.
In der Zwischenzeit mischt man den Erstantikörper mit den passenden PIA-PINK-Maus- oder -Kaninchen-Sekundärantikörpern. Hierzu öffnet man ein Gefäß mit zehn Millilitern PIA-PINK-Maus- oder -Kaninchen-Sekundärantikörpern, gibt 0,5 bis 2 Mikrogramm Primärantikörper hinzu und mischt sorgfältig durch mehrmaliges invertieren. Nach dem Abgießen der Blockierungslösung bedeckt man die Membran mit der Mischung aus Erstantikörper sowie PIA-PINK-Fertigreagenz und inkubiert die Membran etwa eine Stunde bei Raumtemperatur auf einem Orbital-Schüttler; 75 bis 100 Umdrehungen pro Minute sind ideal.
Während der Inkubation kann man die Anreicherung der Goldnanopartikel auf der Membran beobachten, die durch die Immunreaktion vermittelt wird. Nach circa einer Stunde ist das Färbeergebnis deutlich als rote Bande (Western Blot) oder Spots (Dot Blot) sichtbar. Sollte die Färbung nicht zufriedenstellend sein, kann sie unbedenklich fortgesetzt werden. Sind die zugänglichen Bindungsstellen besetzt, erfolgt keine weitere Verstärkung des Signals.
Intensive Rotfärbung
Anschließend nimmt man die Membran aus der Inkubationswanne, spült überschüssiges Reagenz kurz mit Wasser ab und trocknet sie auf Filterpapier. Der Trocknungsvorgang lässt sich durch den Luftstrom eines Kaltluftföhns beschleunigen. Während des Trocknens intensiviert sich die Rotfärbung, zur Dokumentation genügt eine einfache digitale Kamera. Alternativ kann auch ein Gel-Dokumentationssystem mit der Einstellung „Ponceau-Rot“ verwendet werden. Die Intensität der Färbung korreliert mit der Menge des zugänglichen Zielproteins. Die Quantifizierung kann mit einem Gel-Dokumentationssystem oder einer Pixelanalyse des digitalen Bildes erfolgen. Es entsteht kein Überfärben und auch kein störender Hintergrund. Die Intensität der Farbe ist über einen großen Bereich proportional zur aufgetragenen Proteinmenge, die Sensitivität der gebrauchsfertigen PIA-PINK-Färbung liegt im Femtomol-Bereich.
Derzeit ist PIA-PINK für Primärantikörper aus Maus und Kaninchen erhältlich, weitere Spezifikationen und auch kombinierte Eigenschaften, etwa Farbe und Meerrettichperoxidase (HRP) oder Farbe und Fluoreszenz, werden entwickelt.
PiNa-Tec sucht gegenwärtig Anwender aus allen Fachgebieten zur breiten Validierung der PIA-PINK-Produkte. Wenn Sie testen wollen, wie einfach, schnell und zuverlässig PIA-PINK-Blots funktionieren, komme ich gerne zu einem Demobesuch in Ihrem Labor vorbei und stehe Ihnen beim ersten Test des Blots mit Tipps und Tricks zur Seite. Aufgrund der Pandemie-Situation kann dies auch in Form eines Online-Meetings geschehen. Sie erreichen mich per E-Mail (info@pina-tec.de) oder telefonisch unter 040 692 740 09.
Katja Werner
Katja Werner arbeitete fast ein Jahrzehnt als TA am EMBL in Hamburg in der Proteinstruktur-Analytik. Danach wechselte sie zum neugegründeten Zentrum für angewandte Nanotechnologie in Hamburg, um zusammen mit Theo Schotten und Jan Niehaus Nanopartikel für biologische Anwendungen zu entwickeln. Nebenbei machte sie den M.Sc. in Drug Research and Management. 2019 gründete Werner das „Eine-Frau”-Start-up PiNa-Tec, das pinkfarbene, mit Goldnanopartikeln-konjugierte Sekundärantikörper für schnelle und vereinfachte Immunoassays herstellt.