Tipp 234: Der SuperBuffer
(10.05.2021) Die Gruppe „Biomedizinische Analytik” der FH Salzburg suchte nach einem Elektrophorese-Puffer für Agarose-Gele, der schärfere Banden liefert als die üblichen Puffer. Dabei stieß sie auf den SuperBuffer. Hält der Name tatsächlich was er verspricht? Die Salzburger testeten es.
DNA-Agarose-Gele gehören in Molekularbiologie-Laboren zur täglichen Routine. Ist der für die Herstellung der Gele verwendete Puffer einmal etabliert, bleibt man meist dabei. Frei nach dem Motto: „Never change a winning team!“ Hinzu kommt, dass man am liebsten einen Puffer verwendet, den viele andere Gruppen auch benutzen. Wenn ihn fast alle einsetzen, müsste er doch gut sein. Leider gilt diese Annahme nicht immer.
Wir waren schon längere Zeit unzufrieden mit den unscharfen DNA-Banden auf unseren Agarose-Gelen, die wir mit dem altbekannten TRIS-Acetat-EDTA (TAE)-Puffer erhielten. Des Öfteren zweifelten wir an unserer Sehstärke, wenn die Banden wieder einmal sehr diffus waren. Vor allem für das Publizieren von Ergebnissen sind aussagekräftige Bilder nötig, die scharfe, klar definierte Banden von DNA-Fragmenten zeigen.
Auf der Suche nach einer Alternative stießen wir auf den sogenannten SuperBuffer, den eine chinesische Gruppe 2011 entwickelt hatte (Gene 487(1): 72-4). Die Bezeichnung machte uns neugierig – und so überprüften wir, ob der SuperBuffer seinem Namen gerecht wird und so super ist wie beschrieben.
Mit dem ausgedruckten Paper in der Hand ging es ins Labor, um TAE- und SuperBuffer bei der Agarose-Gel-Elektrophorese zu vergleichen.
Zur Herstellung von 400 Milliliter 50-fach SuperBuffer (pH 8,8) benötigt man acht Gramm NaOH, 45 Gramm Borsäure und Aqua Dest. Für den 50-fach TAE-Puffer (pH 8,6) lösten wir 242 Gramm TRIS-Base in 57,1 Milliliter Essigsäure sowie 100 Milliliter 0,5 M EDTA und füllten die Mischung mit Aqua Dest. auf 1 Liter auf.
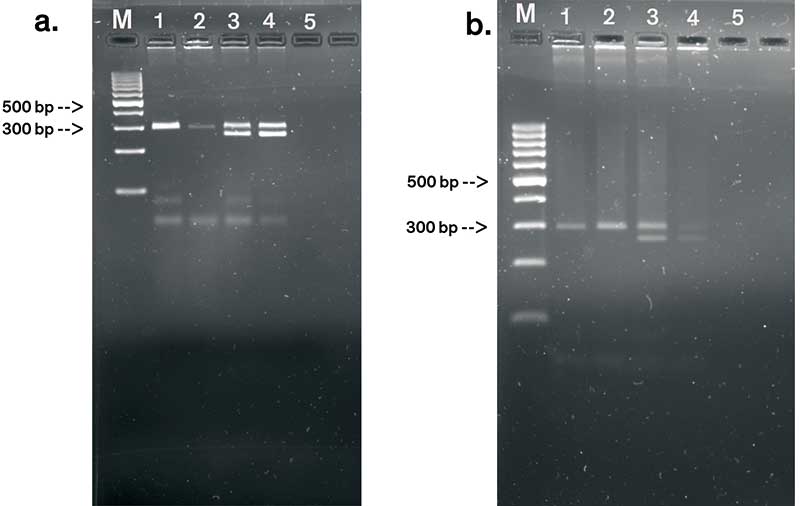
Für den Vergleich stellten wir jeweils zweiprozentige Agarose-Gele her: eines mit 1-fach SuperBuffer und eines mit 1-fach TAE-Puffer. In die erste Probentasche trugen wir einen DNA-Marker auf, in vier weitere PCR-Produkte in gleichen Mengen und in die letzte eine Kontrolle. Danach schlossen wir die Elektrophorese-Kammer an das Netzteil an und starteten die Hochstrom-Elektrophorese (120 V, 45 Minuten). Die Temperatur in der Laufkammer überwachten wir vor und nach dem Lauf mit einem Thermometer.
Schärfere Banden
Anschließend fotografierten wir die PCR-Banden mit einem Gel-Dokumentations-System. Zu unserer großen Freude und auch Überraschung waren deutliche Unterschiede in der Bandenschärfe zu erkennen (siehe Abb.). Der SuperBuffer liefert gut definierte und kompakte DNA-Banden, wohingegen die Banden auf dem Agarose-Gel mit TAE-Puffer wesentlich unschärfer sind.
Die DNA-Banden wandern im SuperBuffer etwas langsamer als im TAE-Puffer. Dies war auch schon den Chinesen aufgefallen: Je hochprozentiger das Gel, desto langsamer die Laufgeschwindigkeit der DNA-Fragmente.
Der Temperaturanstieg in der Laufkammer während des Runs war in beiden Puffern fast identisch. Die Ausgangstemperatur betrug bei beiden Puffern 23 °C, die Endtemperatur im SuperBuffer 29 °C und im TAE-Puffer 28 °C.
Wir verwenden inzwischen nur noch den SuperBuffer. Überzeugt hat uns unter anderem die einfache Herstellung. Von Vorteil ist auch, dass sich die elektrophoretische Wirksamkeit nicht verändert, wenn man den gleichen Laufpuffer mehrfach verwendet. Auch bei den Kosten schneidet er besser ab. Der Umstieg lohnt sich also auch finanziell, insbesondere wenn man viele Agarose-Gel-Elektrophoresen durchführt.
Aber natürlich sind die Ergebnisse am allerwichtigsten, und die waren mit dem SuperBuffer einfach super.
Tanja Karl und Gertie Janneke Oostingh