Tipp 230: In 40 Tagen vom Arabidopsis-Sämling zu neuen Samen
(11.11.2020) Die Aufzucht von Arabidopsis für die Phänotypisierung ist ein zeitaufwendiges und mühsames Geschäft.
Taras Pasternak und Klaus Palme von der Universität Freiburg entwickelten zusammen mit ihrem Kollegen Benedetto Ruperti von der Universität Padua ein Verfahren, das die Kultur vereinfacht und beschleunigt.
Pflanzenphänotypisierung ist die quantitative Analyse der Wechselwirkung einer Pflanze mit ihrer Umwelt. Der Phänotyp ist sowohl vom Genotyp als auch von der Umgebung abhängig.
Besonders gut lässt er sich bei der Ackerschmalwand Arabidopsis thaliana beobachten, die einen extrem kurzen Lebenszyklus und ein kleines Genom aufweist. Sie ist deshalb die beliebteste Pflanze der Pflanzenmolekularbiologie.
Die Arabidopsis-Forschung stützt sich weitgehend auf die phänotypische Analyse der Sämlinge und Charakterisierung der Pflanzenreaktionen auf intrinsische und extrinsische Reize während des In-vitro-Wachstums. Deshalb sollten optimale, stressfreie Wachstumsbedingungen geschaffen und als Referenz verwendet werden – insbesondere in Studien, die darauf abzielen, die pflanzlichen Reaktionen auf abiotischen und biotischen Stress zu charakterisieren.
Bei den derzeit verwendeten Standard-Protokollen für die In-vitro-Kultur und Charakterisierung von Arabidopsis ist die Zusammensetzung des Wachstumsmediums aber nicht optimal. Der unausgeglichene Nährstoffgehalt kann bei den Pflanzen Stressreaktionen auslösen und hierdurch die Ergebnisse von Experimenten verfälschen. Darüber hinaus erfordern die Protokolle das Umpflanzen in Töpfe mit Erde, regelmäßige Bewässerung, spezielle Kultursysteme wie zum Beispiel das ARA-System und ein Gewächshaus. Dies ist nicht nur mit viel Arbeit verbunden, sondern auch mit viel Abfall.
Ist es möglich, die Arabidopsis-Kultur einfacher und standardisierter durchzuführen? Durchaus. Wir haben ein einfaches Protokoll für die In-vitro-Kultur von Arabidopsis-Pflanzen entwickelt, das auf einem optimierten und ernährungsphysiologisch ausgewogenen Kulturmedium basiert. Das Protokoll ist für die Kultur verschiedener Arabidopsis-Mutanten robust anwendbar, einschließlich Mutanten ohne Wurzelsystem (BioRxiv, doi:10.1101/2020.08.23.263491).
Unser In-vitro-Protokoll ermöglicht die schnelle Samenproduktion im großen Maßstab. Die Pflanzen müssen nicht in Boden eingepflanzt werden, was Platz und Zeit spart. Die In-vitro-Kultur findet in einem optimierten Medium statt, dessen Nährstoffgehalt so nah wie möglich an die natürlichen Bodenbedingungen angepasst ist. Durch die Standardisierung aller Kultur-Schritte während des Pflanzenwachstums ermöglicht das Protokoll phänotypische und molekulare Untersuchungen einzelner Pflanzen sowie die Samenbildung auch bei Genotypen mit schwerem Defekt im Wurzelsystem. Darüber hinaus reduziert es die Abfallmenge und den für die Pflanzenkultur nötigen Platz.
Die Kultivierung verläuft in zwei Schritten, wobei alle Arbeitsabläufe von der Samenpflanzung bis zur Gewinnung neuer Samen in einer sterilen Laminar-Flow-Bank durchgeführt werden sollten. Im ersten Schritt wachsen die Sämlinge zwanzig Tage auf einer vertikalen quadratischen Petrischale in einem optimierten TK1-Medium. Das TK1-Medium wurde nach sorgfältiger Bewertung der Funktionen und Auswirkungen aller Nährstoffe auf die Pflanzenentwicklung zusammengestellt und basiert auf einem ausgeglichenen NPK-Verhältnis. Anschließend werden die Pflanzen zwanzig Tage in einem zwanzig Zentimeter langen Reagenzglas mit Hoagland-Medium bis zur Samenbildung und Trocknung kultiviert (siehe Abbildung gegenüber).
Präzise Phänotypisierung
Im ersten Schritt der Kultivierung ist eine präzise Phänotypisierung der Pflanzen möglich, etwa durch regelmäßiges Scannen der Schale sowie Analyse von Wurzelsystemarchitektur und Sprosskinetik.
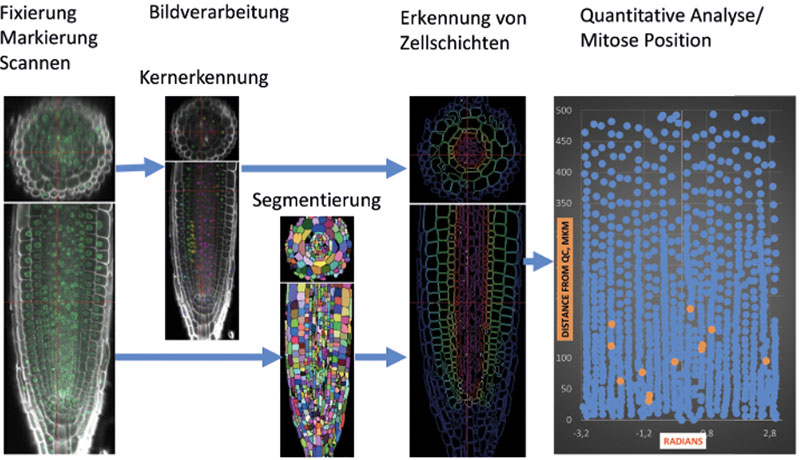
Zusätzlich zur Morphologie auf Organebene ermöglicht das System die Untersuchung der Einzelzellauflösung des apikalen Wurzelmeristems. Eine ein Zentimeter lange Wurzelspitze kann geschnitten, fixiert und hinsichtlich der Zellmerkmale, Genexpression, Zellzyklus und Chromatin-Status analysiert werden (siehe Abbildung).
Auch die Expression eines Fluoreszenz-Markers kann unter einem Binokularmikroskop, das mit einer Leuchtstofflampe ausgestattet ist, direkt auf den Platten nachgewiesen werden. Die Pflanzen können zusätzlich nummeriert werden, um die Kinetik der Entwicklung einfach zu überwachen.
Der zweite Schritt der Kultivierung beginnt, sobald die Blüten erscheinen. Der Spross wird in ein Reagenzglas überführt, das 2,5 Milliliter Hoagland-Medium enthält. Bei Bedarf können Wurzeln zur DNA-Isolierung und Genotypisierung verwendet werden.
Für eine gute Trocknung der Samen ist es wichtig, eine hohe Luftfeuchtigkeit in den Röhrchen zu vermeiden. Deshalb dürfen die Reagenzgläser nur mit einem Baumwolldeckel abgedeckt werden. Nachdem die Samen vollständig trocken sind, können sie unter einer Sterilbank in einer 40-Millimeter-Petrischale oder einem Eppendorf-Röhrchen gesammelt werden.
Die In-vitro-Kultivierung mit unserem Protokoll dauert von der Aufzucht der Sämlinge bis zur Samengewinnung ungefähr 40 bis 45 Tage. Während dieser Zeit ist eine genaue phänotypische und genotypische Charakterisierung möglich – inklusive der eingehenderen Phänotypisierung des apikalen Wurzelmeristems.
Wir verwenden dieses Protokoll seit 2003 routinemäßig und können mit ihm auch Samen aus einer wurzellosen Mutante erzeugen. Die Details finden Sie in unserem Preprint.
Taras Pasternak