Tipp 201: Herstellung von Proteinlysaten aus 3D-Zellkulturen - Verbunden bis zum Schluss
Bei der Herstellung von Proteinlysaten aus 3D-Zellkulturen muss der Experimentator sehr behutsam vorgehen. Die Bindung zwischen den Zellen und der Matrix sollte bis zur Lyse erhalten bleiben.
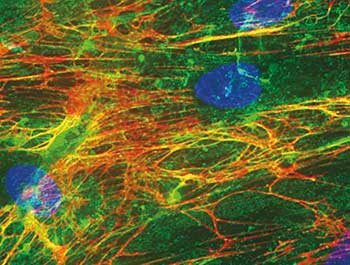
Wahrscheinlich stellen sich viele die Frage: Warum 3D-Zellkultur? 2D tut´s doch auch. Naja, ist doch klar! Wenn wir uns und unsere Umwelt anschauen, stellen wir fest, dass in der Biologie alles dreidimensional aufgebaut ist. Im menschlichen Körper bilden dreidimensionale Zellverbände Organe, das Blutsystem sowie das Knochengerüst. Damit der Zellverband stabil ist und die Organe ihre Form einnehmen können, müssen sich die Zellen untereinander und mit ihrer Umgebung vernetzen.
Die Umgebung ist die sogenannte extrazelluläre Matrix (EZM). Die EZM füllt die Räume zwischen den Zellen aus und besteht aus einer Vielzahl von Proteinen, die ihr Struktur und Festigkeit verleihen und Andockstellen für die Zellen bilden.
Das ist aber noch nicht alles. In der EZM sind Wachstumsfaktoren und Botenstoffe der Immunantwort eingelagert, die je nach Bedarf aus dieser herausgelöst werden und dann spezifische Zellfunktionen stimulieren.
Darüber hinaus ist die EZM selbst durch ihre Zusammensetzung und ihre Festigkeit ein Signalgeber. Spezifische Zellmembran-Rezeptoren nehmen diese Signale auf und leiten sie in die Zelle weiter, die sie schließlich für die Regulation verschiedener Zellfunktionen wie Zellüberleben, Zellteilung, Differenzierung, Zellwanderung und Zelltod verarbeitet.
Segen und Fluch zugleich
Im Idealfall bildet die EZM ein Milieu das die Zelle mit allem Nötigen optimal versorgt. Diese Wechselwirkung von Zelle und EZM ist im „Alltag“ jeder gesunden Zelle überlebenswichtig, bedingt aber Fehlregulationen in erkrankten Zellen, wie zum Beispiel bei Krebs. Hier beschützt die Anheftung an die EZM die Tumorzellen vor der Krebsbehandlung – unterstützt also das Zellüberleben, verringert den Zelltod und fördert die Therapieresistenz.
Deshalb ist ein Ansatz in der Entwicklung neuer Krebstherapien, die Anheftung der Tumorzelle an die EZM zu kappen oder zu stören, um die Heilungsraten durch optimierte molekulare Therapien von Tumorpatienten zu erhöhen.
Rezeptoren, die die Anheftung der Zelle an die EZM vermitteln, heißen Integrine. Integrine durchspannen die Zellmembran und sind nicht nur für die Anheftung notwendig, sie besitzen auch eine Signalfunktion und können Signale von der EZM aufnehmen und in die Zelle weiterleiten. Wegen dieser Eigenschaften werden Integrine als potente Zielmoleküle für die Krebstherapie gehandelt.
Die Expression von Integrinen und EZM-Proteinen ist in vielen Tumoren im Vergleich zu gesunden Geweben stark erhöht. Hinzu kommt, dass Integrine mit verschiedenen Rezeptor-Tyrosinkinasen – darunter wichtige Wachstumsfaktor-Rezeptoren wie der epidermale Wachstumsfaktor-Rezeptor (EGFR) – wechselwirken und überlebenswichtige Signale großteils von dieser Wechselwirkung abhängen.
Komplexe Signalweiterleitung
Dies verdeutlicht, wie komplex der Informationsaustausch zwischen Zelle und extrazellulärem Milieu ist – und damit auch die Signalweiterleitung in der Zelle. Untersuchungen in 2D-Zellkulturen spiegeln diese Situation nicht korrekt wieder, schon alleine deshalb, weil notwendige extrazelluläre Liganden für Integrine und Rezeptor-Tyrosinkinasen fehlen und die Signalweiterleitung stark abweicht.
Hier kommt die 3D-Zellkultur als geeignetes Untersuchungsmodell im Labor ins Spiel. Verantwortlich für die Weiterleitung von Signalen in der Zelle sind die Proteine. Sie können sich gegenseitig aktivieren oder ausschalten, wodurch ein riesiges Regelnetzwerk entsteht, über das Signale sehr spezifisch übermittelt werden. Für die Untersuchungen dieser Signalwege im Labor ist es wichtig, Modelle zu verwenden, die der Physiologie unseres Körpers und des Tumors, wie oben beschrieben, möglichst nahe kommen.
Physiologische Umgebung
In der 3D-Zellkultur wachsen die Zellen nicht flach ausgestreckt auf hartem, artifiziellem Plastik, wie in der konventionellen 2D-Kultur. Sie sind vielmehr in eine Matrix eingebettet, die sich aus den verschiedenen Komponenten der EZM zusammensetzt. Dadurch erreicht man eine physiologische Umgebung und eine physiologische Anheftung der Zellen an EZM-Proteine.
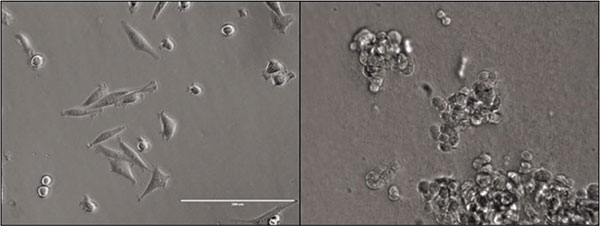
Zahlreiche Studien belegen, dass sich Zellen unter 3D-Bedingungen sehr ähnlich wie in vivo verhalten, es jedoch starke Unterschiede zu 2D-Kulturbedingungen gibt. Angefangen damit, dass die Zellen unter 2D-Verhältnissen ausgestreckt und flach wachsen, während die Zellen in 3D, ähnlich wie in vivo, runder sind. Im Fall von Tumorzellen sind diese in vivo und unter 3D-Bedingungen resistenter gegenüber einer Strahlen- und Chemotherapie, weil weniger letale DNA-Doppelstrangbrüche entstehen als in 2D-Zellkulturen.
Deutliche Unterschiede
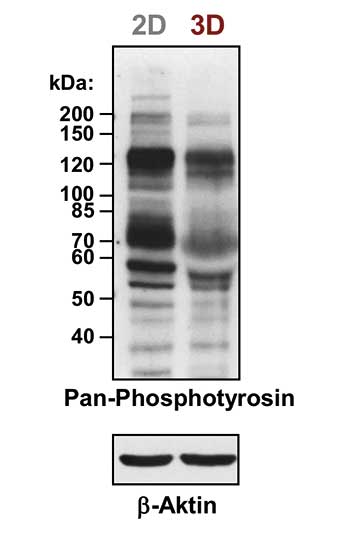
Wie einflussreich die physiologischen 3D-Wachstumsbedingungen sind, zeigt sich an Veränderungen der Genexpression, der Chromatinorganisation und der Expression sowie der Phosphorylierung von Proteinen, die von der 2D-Zellkultur stark abweichen. In der oben stehenden Abbildung ist die Phosphorylierung am Tyrosin aus 2D- und 3D-Zellkulturen zu sehen. Man kann deutlich erkennen, wie stark sich die beiden Phosphorylierungsmuster unterscheiden.
Tatsächlich ist es so, dass unter 3D-Bedingungen weniger Proteine phosphoryliert vorliegen als unter 2D-Bedingungen. Um also physiologisch relevantere Ergebnisse zu erhalten, ohne sofort einen Tierversuch durchzuführen, ist es sinnvoll, 3D-Zellkulturen zu verwenden. Aber CAVE: 3D ist nicht gleich 3D! Im besten Fall kennt man die physiologische EZM-Zusammensetzung des Gewebes, das man untersuchen will. Und 3D ist nicht ganz so einfach wie 2D.
Trotzdem ist es unserem Team am Nationalen Zentrum für Strahlenforschung in der Onkologie an der Technischen Universität Dresden (OncoRay) gelungen, robuste Verfahren für die Untersuchung aller möglichen Endpunkte (zum Beispiel Klonogenität, Proliferation, Zelltod, Invasion) und Moleküle (DNA, RNA, Proteine) in 3D Zellkulturen zu entwickeln.
3D ist nicht gleich 3D
Hierzu zählt auch eine Methode für die Isolierung von Proteinen aus 3D-Zellkulturen. Das entsprechende Protokoll verwenden wir für 3D-Zellkulturen in einer lamininreichen extrazellulären Matrix, etwa Kopf/Hals-Plattenepithelkarzinomzellen, Lungenkarzinomzellen, Pankreaskarzinomzellen oder Prostatakarzinomzellen sowie für Glioblastomzellen in einem Collagen-I-Gel (Eke et al., J Biol Methods 2015;2(4) pii: e31; Eke et al., Int J Oncol 2016 Jan;48(1):313-21).
Es gibt verschiedene Matrices auf dem Markt, aus denen man die optimale für das jeweilige Zellmodell wählen kann. Wenn es ans Experimentieren geht, ist es jedoch sehr wichtig darauf zu achten, die Bindung zwischen Zelle und Matrix nicht schon vor der Lyse oder der Fixierung zu zerstören. Dies würde die Signale in der Zelle unmittelbar beeinflussen und verändern.
Vorsicht ist die Mutter der Zelllyse
Bei der Herstellung von Proteinlysaten nehmen wir (im Fall einer lamininreichen Matrix) die überschüssige Matrix vorsichtig ab, ohne den Zellrasen zu zerstören, und lysieren die Zellen dann direkt im Rest der Matrix. So ist gewährleistet, dass die nachfolgende Proteinanalyse tatsächlich die physiologische Situation widerspiegelt.
Ist das Lysat erst einmal hergestellt, lassen sich damit Western Blot oder Immunpräzipitations-Untersuchungen durchführen. Aber auch Breitbandanalysen wie die Untersuchung des Proteoms und Phosphoproteoms sind möglich.
Die Ergebnisse sollten die Physiologie möglichst gut widerspiegeln, um Zielmoleküle, etwa für eine Krebstherapie, zunächst in vitro im 3D-Modell identifizieren und charakterisieren zu können. Diese kann man dann anschließend im Tierversuch testen.
Wenn wir Ihre Neugier geweckt haben, finden Sie genauere Informationen und Details zur Herstellung von 3D-Proteinlysaten in unseren oben genannten Publikationen.
Ellen Dickreuter & Nils Cordes
Letzte Änderungen: 09.11.2016