Tipp 242: Elektrooptische-Membran-Analyse
(13.06.2022) Bisher konnten Membranforscher ihre Proben entweder elektrophysiologisch mit Voltage-Clamp-Systemen
untersuchen oder visuell mit einem Mikroskop. Mit dem MECA-Opto-Chip aus Freiburg geht beides gleichzeitig.
Physiologen beschäftigen sich häufig mit der Charakterisierung biologischer Membransysteme. Sie interessieren sich dabei insbesondere für die physikochemischen Eigenschaften der Membranen und der darin integrierten Proteine. Neben klassischen elektrophysiologischen Methoden verwenden Membranforscher für ihre Untersuchungen zunehmend auch hochauflösende Varianten der Fluoreszenzmikroskopie. Die Elektrophysiologie ermöglicht eine gezielte Stimulation des Membransystems durch Veränderung des Transmembranpotentials und erlaubt hierdurch präzise Messungen der Leitfähigkeit und Kapazität der gesamten Membran (Voltage-clamp). Mit den optischen Methoden kann der Experimentator das System ortsaufgelöst beobachten – eine einfache In-situ-Stimulation ist mit ihnen aber per se nicht möglich.
Unsere Arbeitsgruppe Membranphysiologie und -Technologie am Physiologischen Institut der Albert-Ludwigs-Universität Freiburg hat ein Chip-basiertes System entwickelt, mit dem man eine Membran elektrophysiologisch untersuchen und gleichzeitig optisch analysieren kann (bioRxiv, doi: 10.1101/2022.04.18.488685). Die Kombination beider Methoden liefert neue Einblicke in die Struktur-Funktionsdynamik von Membransystemen.
Aufgespannte Membran
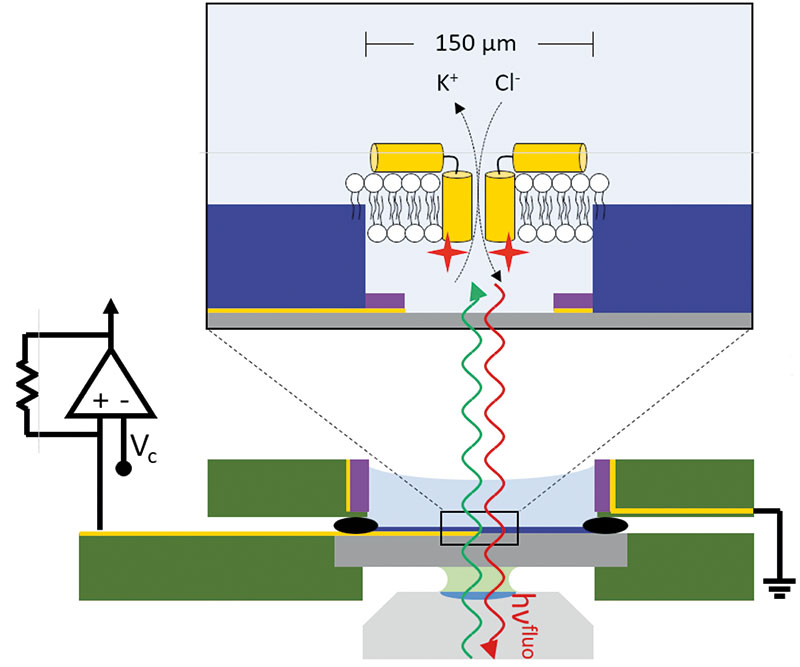
Herzstück der Versuchsanordnung ist der MECA-Opto-Chip des Freiburger Start-ups Ionera Technologies. MECA steht für Micro-Cavity-Electrode-Array. Der Chip enthält vier kreisförmige Vertiefungen (Mikrokavitäten), die mithilfe von Dünnschicht-Techniken (Lithographie) in ein Glassubstrat mit hoher optischer Güte eingearbeitet werden. Jede Kavität ist zwanzig Mikrometer tief und definiert eine Apertur von 150 Mikrometern Durchmesser. Über den vier Aperturen kann jeweils eine einzelne, frei stehende Bilipidschicht aufgespannt werden, wodurch vier unabhängige cis-Kompartimente sowie ein gemeinsames trans-Kompartiment entstehen. Um die Kosten gering zu halten und dennoch ein gutes Handling zu gewährleisten, ist das Glassubstrat in die Struktur eines gedruckten Schaltkreises (PCB) integriert, der den eigentlichen Chip bildet.
Für die elektrophysiologische Charakterisierung beziehungsweise Stimulierung ist ein elektrischer Spannungsgradient über der Lipiddoppelschicht notwendig. Im MECA-Opto-Chip wird das Spannungsgefälle mit Mikroelektroden erzeugt, die in Ring- oder Hufeisenform auf dem Boden der Kavitäten angeordnet sind. Sie werden gegen eine gemeinsame große Ringelektrode auf der trans-Seite betrieben, die in ein Flüssigkeitsreservoir über dem Glassubstrat eintaucht. Die Elektroden lassen sich mit Messverstärkern, etwa dem ORBITmini von Nanion Technologies, ansteuern beziehungsweise auslesen. Die Versuchsanordnung ist quasi ein elektrophysiologisches Labor im Hosentaschenformat, das auf den meisten Mikroskopen Platz findet.
Das MECA-Opto-System zielt aber nicht darauf ab, alle Membranen in den vier Kavitäten gleichzeitig optisch-elektrisch zu analysieren. Die vier Kavitäten sollen vielmehr die Erfolgsrate der Experimente erhöhen und die Frustration des Experimentators senken. Die Chance, eine elektrisch stabile Membran mit einem eingebauten Fluoreszenz-markierten Protein oder einem Peptid in der gewünschten Dichte zu finden, ist in dem vierfachen Ansatz größer als bei einer einzelnen Membran. Und sollte zum Beispiel eine Membran reißen, kann man den ORBITmini auf dem Mikroskoptisch verschieben und das Experiment ohne großen Aufwand mit der nächsten Kavität fortsetzen oder neu beginnen.
Robustes System
In konventionellen Systemen sind die frei stehenden Bilipidschichten von Membranen sehr fragil und lassen sich kaum unter dem Mikroskop beobachten. Mit dem MECA-Opto-Chip ist dies jedoch möglich. Die Chipoberfläche wird von dem wässrigen Elektrolyten zum einen gut benetzt. Sie interagiert aber gleichzeitig auch sehr stark mit den hydrophoben Molekülen der Bilipidschicht und stabilisiert hierdurch die künstliche Membran. Die mit 150 Mikrometern Durchmesser relativ großen Membranen sind so robust, dass man das gesamte System problemlos über mehrere Meter transportieren kann, ohne die frei stehende Bilipidschicht zu beschädigen. Gleichzeitig gewährleisten die Ring- beziehungsweise Hufeisenelektroden die Transmission der Lichtstrahlen durch die Membranen.
Wir verwendeten den MECA-Opto-Chip auf einem konfokalen Mikroskop mit hoher numerischer Apertur, um Diphytanoyl-sn-glycero-phosphocholin(DPhPC)-Membranen zu charakterisieren, die mit einer fluoreszierenden Lissamin-Rhodamin-Phosphatidylethanolamin-Lösung gelabelt waren.
Gekrümmt statt planar
Mithilfe einer angelegten Dreieckspannung bestimmten wir kontinuierlich die Kapazität der Membran und damit auch ihre Dicke. Bisher ging man davon aus, dass derartige Membranen vollständig planar sind. Wir beobachteten jedoch, dass sie deutliche Kurvaturen aufweisen können. Die Kurvatur einer Membran und damit ihre effektive Fläche hat einen direkten Einfluss auf die Einbaukinetik von Membranproteinen beziehungsweise von Membran-aktiven Peptiden.
Zudem untersuchten wir mit dem DPhPC-Membran-System ein Fluoreszenz-markiertes Ceratotoxin-A-Peptid, das unter elektrischer Spannung transiente Poren ausbildet. In der Natur schützt das antibakterielle Peptid die Eier weiblicher Mittelmeerfruchtfliegen (Ceratitis capitata). Es ist aber auch ein wichtiger Wirkstoff-Kandidat für die Tumorbehandlung und wird im Kampf gegen multiresistente Pathogene eingesetzt. Für die Wirkstoffforschung ist es zwingend notwendig, den genauen Insertionsmechanismus zu kennen.
Regulierte Porenbildung
Um die dynamische Ausbildung transienter Toxin-Poren verfolgen zu können, kombinierten wir zwei orthogonal polarisierte Einzelphotonen-Detektoren mit der hochauflösenden Elektrophysiologie. Anhand der auftretenden Fluoreszenz-Anisotropie beobachteten wir, dass zwar sehr viele Moleküle des Peptids an der Membran anhaften, jedoch nur ein geringer Anteil dazu tendiert, Poren zu bilden. Für den erfolgreichen Einbau von Ceratotoxin-A in eine DPhPC-haltige Membran ist also eine sehr hohe Konzentration des Toxins notwendig. Im biologischen System könnte dies bedeuten, dass die Porenbildungs-Aktivität von Ceratotoxin-A vom Typ der Membran abhängt. Möglicherweise schützt dies die Mittelmeerfruchtfliege vor der Selbstintoxikation.
Tobias Ensslen