Tipp 241: Quantifizierung von Amplikons in Gelen
(13.05.2022) PCR-Produkte werden meist mit Spektrophotometern oder qPCR-Geräten quantifiziert, um sie in weiteren Analysen in optimalen Mengen einsetzen zu können. In vielen Fällen reicht hierfür jedoch die relative Quantifizierung
anhand der Banden-Helligkeit auf einem Agarose-Gel völlig aus.
Bei der Arbeit mit DNA müssen oft PCR-Produkte quantifiziert werden, um sie zum Beispiel in anschließenden Analyseschritten in definierten Konzentrationen einsetzen zu können. Für die Quantifizierung von Nukleinsäuren stehen verschiedene Methoden zur Verfügung wie beispielsweise Spektrophotometrie, Fluorometrie oder die quantitative Real-Time PCR (qPCR). Aber sind diese aufwendigen Quantifizierungs-Techniken immer nötig, um die erforderlichen DNA-Mengen für weitere Untersuchungen zu bestimmen?
Unsere Arbeitsgruppe am Johann-Friedrich-Blumenbach-Institut für Zoologie und Anthropologie der Universität Göttingen beschäftigt sich mit der Analyse degradierter DNA aus historischem Knochenmaterial. Für unsere Experimente stehen meist nur sehr begrenzte Mengen an Probenmaterial zur Verfügung. Wir versuchen daher grundsätzlich, sehr wenig Material zu verwenden, um mit diesem möglichst viele Analysen durchführen zu können.
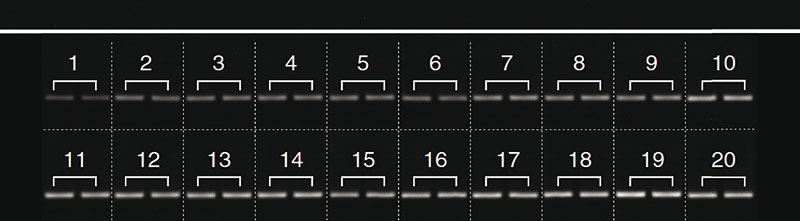
Nach einer PCR überprüfen wir den Erfolg der Amplifikation, der bei degradierter DNA nicht immer gegeben ist, mit einer Agarose-Gelektrophorese. Mit dieser beurteilen wir auch die Spezifität und Effizienz der Reaktion. Wir nutzen dazu 2,5-prozentige Agarose-Gele, die wir nach dem langsamen Lösen und Aufkochen der Agarose in TBE-Puffer mit Ethidiumbromid versetzen. Sowohl die Agarose als auch das Ethidiumbromid sollten gleichmäßig im blasenfreien Gel verteilt sein.
Nach erfolgreicher Amplifikation geht es in der Regel mit einer Kapillarelektrophorese zur Fragmentlängen-Analyse oder einer Sequenzierung weiter. Die hierfür benötigten Mengen schätzen wir einfach anhand der Bandenintensität auf dem Agarose-Gel ab. Die Helligkeit der Banden kann man mit dem frei zugänglichen Bildbearbeitungs- und Analyseprogramm ImageJ quantifizieren (Nat.Methods 9: 671-5). Dazu muss eine geeignete Bilddatei des Agarose-Gels (beispielsweise .tif oder .jpg) mit dem Programm geöffnet werden. Die Funktion „Subtract background…“ unter „Process“ entfernt den Hintergrund des Bildes, sodass nur die Banden auf einem einheitlichen Hintergrund auf dem Bild verbleiben. Mit dem rechteckigen Auswahl-Tool (roter Kreis) kann die erste Bahn auf dem Agarose-Gel umrandet und über „Analyze“ —> „Gels“ —> „Select First Lane“ oder die Tastenkombination STRG+1 ausgewählt werden. Das rechteckige Auswahl-Tool kann man anschließend mit der Maus oder den Pfeiltasten zur nächsten Lane navigieren. Weitere Bahnen können über „Analyze“ —> „Gels“ —> „Select Next Lane“ oder über die Tastenkombination STRG+2 ausgewählt werden. Wenn alle Bahnen auf dem Gel ausgewählt sind und deren Helligkeit quantifiziert werden soll, kann ein Lane Profile Plot über die Funktion „Analyze“ —> „Gels“ —> „Plot Lanes“ oder die Tastenkombination STRG+3 erstellt werden.
Die Peaks auf dem Lane Profile Plot entsprechen den Banden auf dem Agarose-Gel – hellere Banden werden als größere Peaks dargestellt. Die Helligkeit der verschiedenen Banden lässt sich also anhand des Flächeninhalts der entsprechenden Peaks vergleichen. Um den Flächeninhalt der Peaks zu bestimmen, müssen diese erst mit dem Linien-Tool (blauer Kreis) abgegrenzt werden. Anschließend reicht ein einfacher Mausklick mit aktivem Wand-Tool (grüner Kreis) in den Peak, um den Flächeninhalt zu berechnen. Die ermittelten Werte können im Anschluss durch Copy und Paste in ein Tabellenkalkulations- oder ähnliches Programm eingefügt werden.
Um zu prüfen, ob sich mithilfe der Banden-Helligkeit die Menge des PCR-Produkts genau genug bestimmen lässt, haben wir die Methode mit anderen Quantifizierungs-Techniken verglichen (Biotechniques 72 (4), doi: org/10.2144/btn-2021-0094). Die anhand der Banden-Helligkeiten bestimmten Mengen der PCR-Produkte stimmten in unseren Experimenten sehr gut mit den Werten überein, die wir mit spektrophotometrischen und fluorometrischen Methoden sowie der qPCR erhalten hatten. Anhand der Banden-Helligkeiten beziehungsweise Peak-Flächen kann man auch sehr geringe Mengen-Unterschiede erkennen. Die Methode eignet sich daher dazu, die relative Menge von Amplikons zu ermitteln, die für weitere Versuche mit den PCR-Produkten meist ausreichend genau ist. Dabei muss man jedoch beachten, dass nur Banden auf demselben Gel verglichen werden können.
Durch die Analyse der Banden-Helligkeit können wir häufig auf zusätzliche Quantifizierungs-Methoden verzichten und sparen hierdurch zusätzliche Analyseschritte sowie Probenmaterial ein.
Patrick Wittmeier