Fibupeptide – eine neue antibiotische Substanzklasse
von Lucie Proksch (Laborjournal-Ausgabe 9, 2019)
Die Entwicklung neuer Antibiotika ist eine große Herausforderung für Wissenschaftler des 21. Jahrhunderts. Seit der Entdeckung der antibiotischen Wirkung von Penicillinen im Jahr 1928 nahmen die Vielfalt und Verwendung von Antibiotika rasch zu. Allerdings nicht immer mit dem gewünschten Effekt. Prophylaktische Antibiotikagabe in der Tiermast, der Einsatz von Antibiotika bei durch Viren verursachten Erkrankungen sowie abgebrochene Therapien führen dazu, dass Bakterien vermehrt Resistenzen gegen die antibiotisch wirkenden Substanzen ausbilden. Allein in Deutschland starben 2015 knapp 2.400 Menschen an Infektionen mit Antibiotika-resistenten Bakterien, in der EU sogar mehr als 33.000 (Lancet Infect. Dis. ,doi: 10.1016/S1473-3099(18)30605-4).
Einer der bekanntesten Erreger ist der gegen Methicillin und andere Antibiotika resistente Staphylococcus-aureus-Stamm MRSA. Die Arbeitsgruppe GERMAP stellte im Auftrag des Bundesamtes für Verbraucherschutz und Lebensmittelsicherheit, der Paul-Ehrlich-Gesellschaft für Chemotherapie und der Abteilung für Infektiologie der Uniklinik Freiburg in ihrem jüngsten Bericht fest, dass 2014 der Anteil von MRSA in den S.-aureus-Blutkultur-Isolaten im Mittel bei 11,8 Prozent lag. Für Deutschland ist das zwar ein rückläufiger Trend (2011 lag der Anteil noch bei 16,1 Prozent), dennoch bleiben MRSA gerade für immungeschwächte Personen, ältere Menschen und Säuglinge eine Gefahr. Deshalb sind sich Forscher einig: Alternative Behandlungsmethoden müssen her.
Nachbarschaftsstreit
Im Jahr 2016 untersuchten Infektionsbiologen der Uni Tübingen das Mikrobiom der menschlichen Nasenschleimhaut (Nature, 535: 511-6). Die Gruppe um Studienleiter Andreas Peschel und Erstautor Alexander Zipperer fragten sich, wie die Bakterien sich gegenüber benachbarten Konkurrenten in der Schleimhaut durchsetzen können. Denn das Nährstoffangebot in unserer Nase ist nur begrenzt. Viele Bakterien können sogenannte Bacteriocine bilden, die andere Prokaryoten im Wachstum hemmen oder abtöten. Doch im menschlichen Mikrobiom hatten Forscher bislang nur sporadisch bakterielle Stämme entdeckt, die sich diesen Verteidigungsmechanismus zunutze machen.
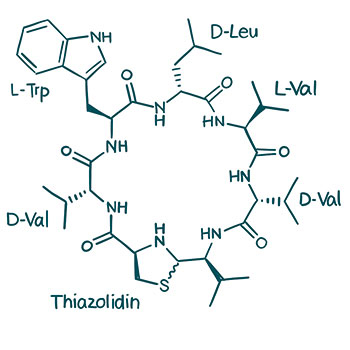
Also isolierten die Tübinger Infektionsbiologen Bakterien der Nasenschleimhaut und führten Co-Kultivierungsversuche mit S.aureus durch. Dieses Setting zeigte, dass der Keim in Anwesenheit des nasalen Bakteriums Staphylococcus lugdunensis überhaupt nicht wachsen konnte. Grund dafür ist ein von S. lugdunensis produziertes cyclisches Peptid, das die Tübinger Gruppe Lugdunin taufte.
Lugdunin zeichnet sich durch einen Schwefel- und Stickstoff-haltigen Thiazolidinring aus, der wie eine „Verschlussspange“ im Zentrum des Peptids liegt. Die Substanzklasse dieser macrocyclischen Peptide mit ebendiesem Thiazolidin bezeichnet man deshalb auch als Fibupeptide, abgeleitet vom lateinischen Wort fibula, Gewandnadel.
In einer Folgestudie untersuchten Stephanie Grond sowie Erstautorin Nadine Schilling vom Institut für Organische Chemie der Uni Tübingen zusammen mit Zipperer und Peschel, welche Strukturen für die antimikrobielle Wirkung von Lugdunin verantwortlich sind und welcher Wirkmechanismus zugrunde liegt (Angew. Chemie, doi: 10.1002/ange.201901589). Struktur-Aktivitätsuntersuchungen ergaben, dass alternierende D- und L-Aminosäuren, Tryptophan, Leucin, und ein N-substituiertes Thiazolidin der Grund dafür sind, weshalb Lugdunin Bakterien wie S. aureus so zu schaffen macht.
Designte Derivate
Weil Tryptophan und Leucin überdurchschnittlich häufig in Peptiden vorkommen, die mit der bakteriellen Zellmembran wechselwirken, vermutete die Tübinger Gruppe, auch Lugdunin würde mit dem hydrophoben Bereich von Bakterien-Zellmembranen interagieren. Diese Vermutung konnten die Chemiker mit weiteren Ergebnissen untermauern und gingen sogar einen Schritt weiter: Um die Wechselwirkung zwischen Peptid und Membran zu verstärken, entwarf das Team ein Fibupeptid mit zwei Tryptophanen. Das speziell designte Derivat überraschte mit einer zweifach stärkeren Wirkung als das „gewöhnliche“ Lugdunin.
In einem weiteren Ansatz baute die Gruppe d-Propargylglycin ein und erhielt ein anderes Derivat mit einer vergleichbaren Aktivität wie Lugdunin. Das neu entstandene Peptid hat allerdings einen entscheidenden Vorteil: Denn es ist für „1,3‐dipolare Cycloadditionen geeignet, was die Produktion weiterer Analoga, bevorzugt mit Wirkung gegen Gram‐negative Bakterien, ermöglicht“, wie die Gruppe in ihrer Publikation schreibt.
Aber warum wirkt das Fibupeptid überhaupt antimikrobiell? Vermutlich beeinflusst Lugdunin den bakteriellen Membrantransport. Denn wie Grond et al. zeigen konnten, gleicht Lugdunin den pH‐Gradienten in künstlichen Membranvesikeln unter Erhalt der Membranintegrität aus. Interessanterweise scheint das cyclische Peptid nicht über stereospezifische Rezeptor-Ligand-Wechselwirkungen zu funktionieren, denn beide Enantiomere (Spiegelbildisomere) haben die gleiche antimikrobielle Wirkung.
Die molekularen Wirkmechanismen des Fibupeptids sind also weiterhin unbekannt. Außerdem knobeln die Chemiker noch an der Frage: Wirkt Lugdunin nun als mobiler Protonen-Transporter oder doch eher durch Bildung von Kanälen?
Letzte Änderungen: 10.09.2019