Arginylation
von Petra Stöcker (Laborjournal-Ausgabe 10, 2006)
Posttranslational geschieht ja noch eine ganze Menge. Ist erst einmal die Übersetzung der Nucleinsäuresequenz der mRNA in die Aminosäuresequenz der Proteine geglückt, wird an fast jedem zellulären Protein noch weiter chemisch oder proteolytisch gebastelt. Da wird gefaltet, azetyliert, carboxyliert und gespalten, was die Organellen hergeben. Gut, dass die Zelle im Normalfall weiß, was zu tun ist, den Wissenschaftlern hingegen bleiben einige Details dieser Aktionen noch verborgen.
Geheimnisvolle Modifikation
So auch die der Protein-Arginylation. Diese geheimnisvolle, posttranslationale Modifikation wurde zwar schon vor etwa vierzig Jahren beschrieben, trotzdem blieben deren molekulare Effekte und Target-Proteine bislang größtenteils im Dunkeln.
Die bekannten Einzelheiten darüber sind schnell erklärt: Im Mittelpunkt des Ganzen steht die Arg-transfer-RNA (-tRNA)-Protein-Transferase (Ate1). Sie überträgt einen Arginylrest (der basischen Aminosäure Arginin) von der tRNA auf den N-Terminus von Proteinen unter Ausbildung einer Peptidbindung. Reaktionspartner dafür sind die Aminosäuren Asparaginsäure (Asp), Glutamin (Glu) und Cystein (Cys), die zuvor proteolytsich verändert werden müssen.
Ate1 ist ein evolutionär gut konserviertes Enzym mit einer tragenden Rolle bei der Embryonalentwicklung. Dessen Knockout in Mäusen führt zu tödlichen Schäden am Embryo und schweren Defekten bei der Angiogenese und der kardiovaskulären Entwicklung. Die Arginylation muss also nicht ganz unwichtige Proteine
in vivo betreffen, die aber bisher hübsch inkognito blieben.
Trotzdem gelang es kürzlich einem wissenschaftlichen Team um Marina Karakozova und Anna Kashina vom Department of Animal Biology der University of Pennsylvania und dem Scripps Research Institute in La Jolla, sowohl die Identität eines Target-Proteins als auch den Zweck seiner Arginylation zu lüften (
Science Vol. 313, S.192-196).
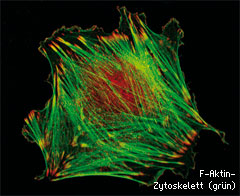
Als Versuchskaninchen diente das Strukturprotein Aktin. Sein Anteil in so ziemlich allen eukaryotischen Zellen beträgt je nach Zelltyp zwischen ein und zehn Prozent. Die monomere globuläre Form (G-Aktin) polymerisiert zu Aktinfilamenten (F-Aktin), die das so genannte Aktinzytoskelett ausbilden. Durch dessen flexiblen Aufbau bleibt die Zelle in ihrer Form schnell anpassungsfähig und beweglich.
Aktin besteht aus ungefähr 375 Aminosäuren und wird von einer Familie hochkonservierter Gene kodiert. Die humane Version besteht aus den Isoformen α-, β- und γ-Aktin.
In vivo wird es N-terminal acetyliert und ein bis zwei endständige Methionine werden abgespalten. Damit bleiben endständig arginylierbare Aminosäurereste an allen Isoformen übrig: Cys2 oder Asp3 im α-Aktin, Asp2 oder Asp3 im β-Aktin und Glu2 oder Glu3 im γ-Aktin.
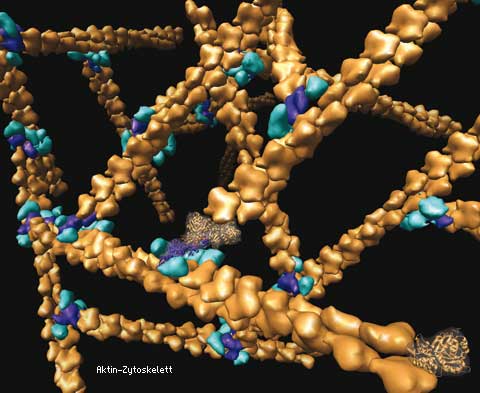
Anhand von Lysaten aus embryonalen Maus-Fibroblasten fischten Karakozovas Mitarbeiter mittels 2D-Gelelektrophorese, Massenspektrometrie und Recherchen in verschiedenen Sequenzdatenbanken arginyliertes β-Aktin heraus. Interessant war nun, dass der Arginylrest zwar nicht die Stabilität des Aktins verändert, wohl aber die Filament-Konstruktion entscheidend beeinflusst. Als Schlüsselenzym kristallisiert sich hier die Arg-Transferase heraus. Das Aktinzytoskelett ist in einer gesunden Zelle in Bündeln und Netzwerken aus einzelnen Filamenten angeordnet, wodurch sie die Plasmamembran ähnlich einem Chassis durch eine Art Rahmen versteifen und damit die Zellgestalt festlegen.
In Ate1
-/--Zellextrakten bildeten sich wilde, ungeordnete Filament-Knäuel, die weder für Zellmembranstabilität sorgen können noch zur Ausbildung von funktionsfähigen Lamellipodien (Membranausstülpungen) fähig sind, die für Beweglichkeit der Zelle unerlässlich sind.
Tragende Rolle
In Immunofluoreszenz-Färbungen von Ate1
-/--Zellen im Vergleich zu ihren Wild-Typ-Kollegen sind Ate1
-/--Fibroblasten bei dem Versuch, in eine Wunde einzuwandern, den Ate1
+/+-Zellen klar unterlegen - in ihrer Anzahl ebenso wie in der Länge ihrer Lamellipodien. Aus den Untersuchungen von Karakozovas Team wird deutlich, dass das Anheften eines Arginylrestes zu den wirklich wichtigen N-terminalen Prozessierungsschritten für funktionstüchtiges Aktin zählt.
Über das Warum und Wieso lassen zusätzlich die Kristallstrukturdaten und die Informationen über die intrazelluläre Aktin-Architektur einige Schlüsse zu: Durch die exponierte Lage von Asp/Glu-Aminosäure-Seitenketten und Azetyl-Gruppen am N-Terminus sind die Aktin-Filamente leicht negativ geladen. Das strukturmässig klobige Arginin bringt positive Ladung mit. Vermutlich wird jede fünfte Untereinheit des Aktins arginyliert, was der Zelle die Ausbildung eines gleichmässigen Netzes erlaubt.
Soweit die schnöde Theorie. In der weitaus komplexeren
in vivo-Welt einer Zelle muss man zwischen den Isoformen β- und γ-Aktin unterscheiden. Dabei bildet β-Aktin als die vorrangig arginylierte Isoform das Zytoskelett aus, wohingegen Arginyl-freies γ-Aktin sich zu dicht gepackten "Spannungs-Fasern” formt, also längs angeordnete Faserbündel, die den Zellkörper durchziehen.
Man darf gespannt sein, welche Proteine in der Zukunft zu Tage gefördert werden, denen erst ein Arginylrest die nötige Rafinesse verleiht.
Letzte Änderungen: 18.10.2006