Epigenom
von Harald Zähringer (Laborjournal-Ausgabe 05, 2001)
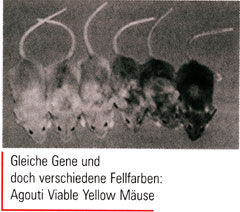
Im November 1999 veröffentlichte Emma Whitelaw vom Department of Biochemistry der Universität Sidney eine verblüffende Arbeit in Nature Genetics. Ihre Gruppe untersuchte Agouti-Mäuse, die Träger des so genannten Agouti Viable Yellow (A
vy) Allels sind. Ein virales Retro(trans)poson, also ein bewegliches DNAElement im A
vy-Gen, führt zur konstitutiven Expression des Agouti-Proteins in den Haar-Follikeln. A
vy-Mäuse haben dadurch ein buttergelbes Fell - im Gegensatz zum braunen Fell normaler Agouti-Mäuse. Das Retroposon desA
vy-Gens ist jedoch unterschiedlich stark methyliert: Ist der Anteil an methyliertem Cytosin (5-Methyl-Cytosin) in den CpG-Dinukleotiden des Inserts hoch wird die A
vy-Expression reprimiert. Als Folge haben isogene, also genetisch identische A
vy-Mäuse, Fellfarben, die von Buttergelb bis Braun reichen. Solch eine Modifikation der Genexpression somatischer Zellen, allein durch Variation der DNA-Methylierung oder der Chromatin-Struktur - also ohne Änderung der Gen-Sequenz - wird als Epigenetik bezeichnet.
Bisher nahmen Entwicklungsbiologen an, dass epigenetische Eigenschaften in Keimzellen von Säugetieren "gelöscht", und nur die auf der DNA-Sequenz fußenden Ausprägungen über die Keimbahn weitergegeben werden. Nicht so in diesem Fall: Der Nachwuchs einer buttergelben A
vy-Mäusemama hat stets ein buttergelbes Fell - die epigenetische Prägung der Fellfarbe wird demnach auf die Nachkomrnen übertragen.
Stumme Gene
Epigenetisch kontrollierte Gene sind oft vollständig stumm. Auslöser dieses Gene-Silencing sind DNA-DNA- oder RNA-RNA-Interaktionen, die Modifikationen der DNA induzieren - in Säugerzellen meist die Methylierung von CpG-Dinukleotiden. So ist die DNA-Methylierung entscheidend am genomischen Imprinting beteiligt, durch das gezielt nur Allele, die von einem Elternteil stammen, reprimiert werden. Auch die so genannte XChromosom-Inaktivierung, bei der die Expression eines der beiden X-Chromosomen während der weiblichen Embryonalentwicklung stillgelegt wird, wird durch DNA-Methylierung gesteuert. Die Methylierung bietet der Zelle einen einfachen Weg, epigenetische Expressionsmuster bei der mitotischen und - wie Whitelaws Mäuse zeigen - in seltenen Fällen auch der meiotischen Zellteilung zu vererben. 5-Methyl-Cytosin wird daher auch als fünfte Base des genetischen Cods bezeichnet. Neben der Sequenz-Information im Genom, enthält jede Zelle im Epigenom also auch eine Anleitung für die Gen-Expression. Im Fall vielzelliger Organismen bedeutet dies: Die verschiedenen Zelltypen haben jeweils ihren eigenen Epigenotyp.
Rennaissance der Epigenetik
Mediziner vermuten epigenetische Effekte wie das genomische Imprinting als Ursache für viele ungeklärte Phänomene, die bei komplexen genetischen Krankheiten auftreten. Zu diesen Rätseln zählen: Geschlechtsspezifische Krankheitsrisiken, etwa die größere Anfälligkeit von Frauen für Multiple Sklerose oder Arthrithis; die vom Geschlecht des kranken Elternteils abhängige Krankheitsvererbung bei Asthma und Epilepsie; unterschiedliche Krankheitsverläufe bei eineiigen Zwillingen oder die Abhängigkeit des Krankheitsausbruchs vom Alter - vielschichtige Krankheiten brechen trotz genetischer Disposition meist erst im höheren Alter aus.
Wiederentdeckt wurde die Epigenetik in der Krebsforschung. Hier weicht die Vorstellung, dass allein genetische Ursachen für die Krebsentstehung verantwortlich sind, zunehmend der Erkenntnis, dass auch epigenetische Fehlregulationen die Tumor-Genese fördern. So korreliert insbesondere die Hypermethylierung von Tumorsuppressor-Genen und die damit verbundene Stilllegung dieser Gene mit der Tumorentwicklung. Methylierungsmuster könnten daher als Tumormarker oder zur Risikoabschätzung dienen. Da die DNA-Methylierung im Prinzip reversibel ist, eröffnet der Eingriff in den Methylierungsprozess auch einen Therapieansatz.
Epigenomik
Die Epigenome gesunder und kranker humaner Zellen entziffern und vergleichen will deshalb das im Dezember 1999 gestartete Humane Epigenom Consortium (HEC). In die Wege geleitet wurde dieses von der EU mit 1,2 Mio. Euro geförderte Projekt von der Berliner Epigenomics AG, Die von Alexander Olek 1998 gegründete Firma hat mit ihrer 5111 BASE Genomics®-Technologie eine Methode entwickelt, mit der das Methylierungsschema erfasst und als Digitaler-Phänotyp® gespeichert werden kann. Als akademische Partner hat Epigenomics unter anderem das Sanger Center mit Stephen Beck, das Centre National de Genotypage in Paris, Jörn Walters Team vom Berliner MPI für Molekulargenetik und Jörg Hoheisels Gruppe am DKFZ in Heidelberg an Land gezogen. In einem weiteren, im März diesen Jahres gestarteten Projekt, wollen die "Spezialisten für die fünfte Base" das Methylierungsmuster für die Onkogene der RAS-Signalkaskade erstellen. Kooperationspartner sind hier die Berliner Charite und das Institut für Theoretische Biologie der Berliner Humboldt Universität.
Letzte Änderungen: 20.10.2004