Mehr als nur Antikörper
Mario Rembold, Laborjournal 05/2021
(10.05.2021) Bei milden COVID-19-Verläufen kommen offenbar zwei Dinge zusammen: Eine gelungene angeborene
Immunantwort und T-Zellen, die sich an die verschiedensten Virus-Antigene erinnern.
Ein Special über zelluläre Immunität im Jahr 2021 – das geht natürlich nicht ohne einen Blick auf SARS-CoV-2. Vor einem Jahr drehten sich noch viele Diskussionen um Antikörper-Tests und deren Validierung: Führt eine überstandene Infektion tatsächlich auch zu neutralisierenden Antikörpern, die eine Neuinfektion verhindern? Und wie lange würden schützende Immunglobuline G (IgG) gegen SARS-CoV-2 erhalten bleiben?
Schnell verlagerte sich der Blick dann auf die T-Zellen. Obwohl bei einigen genesenen COVID-19-Patienten kaum IgG messbar waren oder deren Titer schnell wieder zurückgingen, bestätigte sich glücklicherweise, dass die meisten Menschen nach überstandener Infektion vorerst immun sind oder zumindest nicht erneut schwer erkranken. Die Antikörper im Blut sind nur die halbe Miete, denn für eine erworbene Immunität braucht es auch ein Gedächtnis auf T-Zell-Ebene. Ein Corona-Impfstoff, der damals noch Zukunftsmusik war, sollte also nicht bloß die Produktion von Antikörpern induzieren, sondern auch die T-Zellen auf eine SARS-CoV-2-Infektion vorbereiten. Das ist dann schneller gelungen, als ursprünglich selbst Optimisten erwartet hatten.
Andere Hoffnungen, die wir in die T-Zellen gesetzt haben, blieben bislang unerfüllt. So etwa die Sache mit der Kreuzimmunität: Eine Infektion mit einem endemischen Coronavirus könnte doch vor einer symptomatischen SARS-CoV-2-Infektion schützen. Vielleicht stünden wir gar kurz vor der Herdenimmunität! Spätestens der Herbst belehrte uns dann eines Besseren, auch wenn über Kreuzimmunität noch immer diskutiert wird.
Nach wie vor ist unklar, warum einige Menschen nur mild erkranken und andere schwerste Verläufe entwickeln, selbst wenn sie keiner auf den ersten Blick ersichtlichen „Risikogruppe“ angehören. Und auch hier haben wohl T-Zellen ihre Finger im Spiel.
Spezieller Trick
In einem im Januar online erschienen Review bringen die kalifornischen Immunologen Alessandro Sette und Shane Crotty Ordnung in die bisherigen Erkenntnisse zur adaptiven Immunantwort gegen SARS-CoV-2 (Cell 184(4): 861-80). Ein Virus, so schreiben sie, brauche immer einen speziellen „Trick“, um den Organismus zu befallen. Und SARS-CoV-2 sei sehr erfolgreich darin, die frühe Immunantwort zu umgehen.
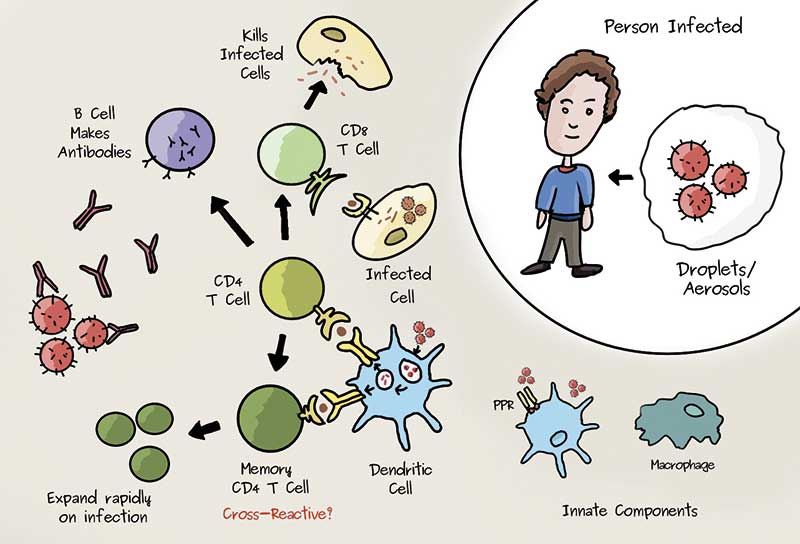
Normalerweise reagiert das angeborene Immunsystem auf virale Angreifer und löst durch die Ausschüttung von Interferonen Alarm aus. Diese frühe Reaktion fällt mit SARS-CoV-2 aber geringer aus. So kommt auch die adaptive Immunantwort erst später zum Zug, und das Virus hat die Chance, ordentlich zu replizieren.
Bei einer durchschnittlichen und eher milden SARS-CoV-2-Infektion steigen die Zytokine der angeborenen Immunantwort mit etwas Verzögerung und weniger stark an als bei anderen Infektionen. Anschließend geht die Anzahl der spezifischen T-Zellen nach oben, und auch Antikörper werden freigesetzt. Offenbar kommt es vor allem auf die T-Helferzellen an, um die Viren zielgerichtet zu bekämpfen. Sie vermitteln auch den B-Lymphozyten das Signal, Antikörper zu produzieren. Niedrige T-Zell-Spiegel sind mit schwereren Verläufen assoziiert. Bei schweren Verläufen können die frühen Signale des angeborenen Immunsystems zunächst ausbleiben, um sehr viel später dann umso stärker in die Höhe zu schießen. Das Immunsystem antwortet gewissermaßen mit dem Holzhammer, selbst wenn nun kaum noch Virus repliziert. Daher auch die Mahnung der Experten, sich nicht auf aktuell freie Intensivbetten zu verlassen – denn wer sich heute infiziert und einen schweren Verlauf vor sich hat, landet erst rund zwei Wochen später in der Klinik.
Ein Team der Medizinischen Hochschule Hannover unter Leitung von Rainer Blasczyk und Britta Eiz-Vesper rekonstruierte den Verlauf einer SARS-CoV-2-Infektion auf zellulärer und humoraler Ebene (Immunity 54(2): 340-354). Als Grundlage dienten 82 gesunde Kontrollpersonen, die sozusagen den Zustand vor der Infektion repräsentieren, 92 Teilnehmer mit akuter COVID-19-Erkrankung sowie 204 genesene Probanden nach überstandener Infektion. Aus Blutproben hatten die Forscher Immunzellen isoliert und diverse Entzündungsmarker im Plasma bestimmt.
Dem Anstieg der Viruslast folgte ein deutlicher Anstieg SARS-CoV-2-spezifischer T-Zellen – die Virusmenge ging danach in der Regel wieder zurück. „Bei den meisten Personen haben wir T-Zellen gegen viele verschiedene virale Proteine detektiert“, berichtet Erstautorin Agnes Bonifacius.
Die Wissenschaftler suchten auch nach T-Zellen gegen gewöhnliche Erkältungs-Coronaviren. „Es zeigte sich, dass genesene COVID-19-Patienten nach mildem Verlauf und stärkeren Antworten gegen diese endemischen Coronaviren auch tendenziell stärkere Antworten auf SARS-CoV-2 haben.“ Im Paper diskutieren die Autoren, dass vorangegangene Infektionen durch andere Coronaviren womöglich einen milderen Verlauf begünstigen könnten. Bonifacius betont aber, dass allein aus diesen Daten keine Rückschlüsse auf Kreuzreaktivitäten möglich sind. „Wir wissen ja nicht, in welchem Umfang die T-Zell-Antworten vor der Infektion bereits vorhanden waren.“
Kreuz mit Kreuzreaktivität
Die Sache mit der Kreuzreaktivität bleibt also umstritten. Fest steht, dass einige T-Zellen Antigene binden, die sowohl in SARS-CoV-2 als auch in endemischen Coronaviren zu finden sind. „Man weiß, dass diese kreuzreaktiven Immunantworten vorkommen, aber man weiß nicht, ob sie eine klinische Bedeutung haben“, ordnet Maike Hofmann diese Befunde ein. Hofmann leitet eine Forschungsgruppe an der Uniklinik Freiburg, die eigentlich T-Zell-Antworten bei Hepatitisvirus-Infektionen auf den Grund geht. Nun setzen die Freiburger ihr methodisches Knowhow gegen SARS-CoV-2 ein.
„Bei unserer aktuellen Studie haben auch wir ein Epitop identifiziert, für das es solche Kreuzreaktionen gibt, wobei wir das Glück hatten, auf historische Proben vom Sommer 2019 zurückgreifen zu können“, so Hofmann. Die Spender dieser Zellen hatten also definitiv noch keinen Kontakt zu SARS-CoV-2. Wie Hofmann war an der erwähnten Studie auch Christoph Neumann-Haefelin als Senior-Autor beteiligt. Auch er äußert sich in Sachen Kreuzreaktivität zurückhaltend. „Als Laborphänomen gibt es das, aber ein substanzieller Effekt für den Infektionsverlauf ist damit wohl nicht verbunden.“
Auch Neumann-Haefelin forscht außerhalb der Pandemie an Hepatitisviren. Er und Hofmann haben mit einer Reihe weiterer Autoren zum Jahreswechsel in Nature Medicine über ihre Ergebnisse berichtet (27(1): 78-85). Das Team hatte nach CD8-T-Zellen gesucht, die auf SARS-CoV-2-Antigene reagieren. „Wenn eine T-Zelle ihr Antigen erkennt, produziert sie beispielsweise Interferon-gamma als Effektormolekül“, beschreibt Hofmann die Versuche. Im „echten Leben“ würde dieses Signal dann zu einem antiviralen Effekt führen. Über das Interferon-gamma werden dann auch weitere Komponenten des Immunsystems rekrutiert.
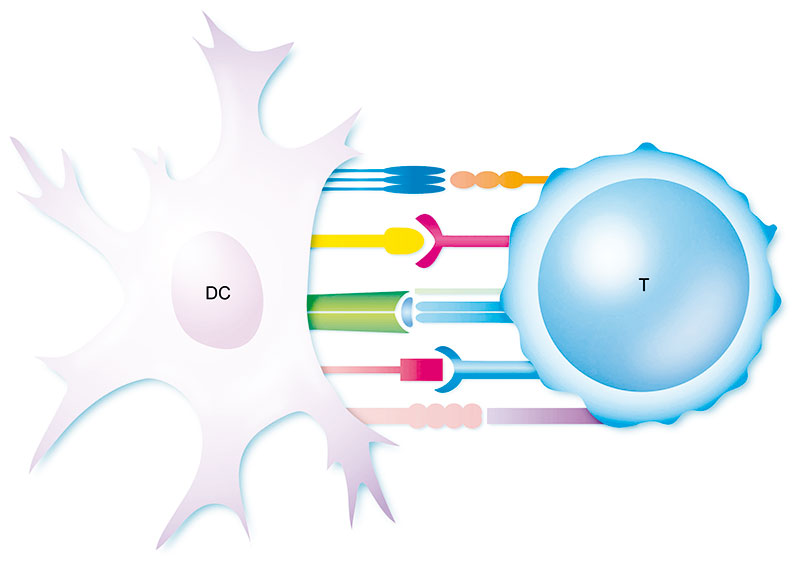
Am Anfang der Studie stand die Bioinformatik. „Zunächst ließen wir vorhersagen, welche Proteinteile bei der Verteilung der HLA-Allele unserer Bevölkerung die wahrscheinlichsten T-Zell-Epitope sind“, schildert Neumann-Haefelin die Vorarbeiten. Über HLA-Moleküle präsentieren fast alle Körperzellen Proteinfragmente auf ihrer Oberfläche, die dann von Immunzellen überprüft werden. Speziell für die Erkennung durch T-Zellen sitzen potenzielle Antigene auf Klasse-I-HLA-Molekülen (auch MHC-Klasse-I genannt). „Diese binden Peptide, die im Schnitt acht bis zehn Aminosäuren lang sind und je nach HLA-Allel an der zweiten und letzten Position spezifische Aminosäuren tragen“, so Neumann-Haefelin weiter.
Insgesamt 66 Epitope kamen in die engere Auswahl. Aus den Epitopen und HLA-Proteinen haben die Freiburger dann tetramere Moleküle gebastelt, um passende T-Zellen aus dem Blut einzelner Probanden herauszufischen und per Durchflusszytometrie anzureichern. „Das ist eine hochsensitive Methode, mit der wir auch sehr seltene virusspezifische T-Zellen analysieren können“, freut sich Hofmann.
Schnelle Antwort
„Wir waren überrascht, wie gut das geklappt hat“, gibt Neumann-Haefelin zu. Zu Hepatitisviren seien diese T-Zellen nämlich viel schwerer zu fassen. Wie andere Arbeiten auch legen die Ergebnisse aus Freiburg nahe, dass SARS-CoV-2 zu einer schnellen und breiten T-Zell-Antwort führt und etliche verschiedene Epitope der unterschiedlichen Virusproteine erkannt werden. Unter anderem detektierte das Team in acht genesenen Patienten, die in AntikörperTests negativ blieben, SARS-CoV-2-spezifische CD8-T-Zellen.
Auch wenn die Autoren diese Ergebnisse mit Vorsicht interpretieren, passt es doch zur Vermutung, dass die zelluläre Immunantwort das Virus bei einigen Infizierten mehr oder weniger „im Hintergrund“ beseitigen kann, ohne die Antikörper-produzierenden B-Zellen einzubinden. Auch bei geringen Titern neutralisierender Antikörper könnte dann sehr wohl eine zelluläre Immunität bestehen.
Zum Vergleich haben die Wissenschaftler auch CD8-T-Zellen angereichert, die spezifisch für Antigene anderer Erreger sind, etwa Epstein-Barr-Virus, Cytomegalovirus und Influenzavirus. Diese T-Zellen haben sie dann aktiviert und deren Antworten gemessen. „Diese Versuche dienten als Kontrolle, um die Ergebnisse aus den Experimenten mit den SARS-CoV-2-Antigenen besser einordnen zu können“, so Hofmann.
Effiziente T-Zellen
„Die Frequenzen an SARS-CoV-2-spezifischen T-Zellen sind eher gering“, stellt Hofmann fest. Das erinnere an die Antwort auf Hepatitisviren. Doch, so heißt es in der Publikation, die CD8-T-Zellen seien sehr effizient auf die Antigen-Erkennung eingestellt. Hofmann: „Die Eigenschaften der Gedächtnis-T-Zellen ähneln denen gegen Influenzaviren, und die Influenzaviren-spezifischen T-Zellen werden oft herangezogen, wenn man von klassischen Gedächtnis-T-Zellen spricht.“
Hofmann und Neumann-Haefelin bestätigen, dass die initiale angeborene Immunantwort eine Rolle spielen könnte für den weiteren Infektionsverlauf. „Die adaptive Immunantwort kann nur gut sein, wenn auch die angeborene Immunantwort funktioniert“, so Hofmann, „und bei SARS-CoV-2, aber auch bei anderen Viren, ist das Typ-1-Interferonsystem ein sehr wichtiger Mediator für antivirale Immunität“. Neumann-Haefelin fügt hinzu, dass nach einer natürlichen SARS-CoV-2-Infektion die Antikörper nicht immer stark ausgeprägt sind und auch schnell wieder verschwinden. „Offensichtlich können angeborene Immunantwort und T-Zellen schon den Großteil des Jobs erledigen.“
Neutralisierende IgG, wie sie auch infolge einer Impfung erwünscht sind, blocken einen Erreger natürlich ab, bevor er sich überhaupt replizieren kann. So scheint auch eine „sterile Immunität“ plausibler, bei der ein Geimpfter nicht nur symptomfrei bleibt, sondern auch die Ausbreitung des Virus in der Bevölkerung verhindert. Andererseits sind IgG insofern limitiert, als sie nur die Oberfläche des Eindringlings erreichen können. So zielen die derzeit zugelassenen Corona-Impfstoffe allesamt auf das Spike-Protein an der Virusoberfläche. Andererseits kontert SARS-CoV-2 genau dort mit Escape-Mutationen, um neutralisierenden Antikörpern zu entgehen.
Die mögliche Vielfalt an Antigenen für T-Zellen hingegen ist weit größer, auch wenn die T-Zellen erst aktiv werden, wenn das Virus schon einige Zellen infiziert hat. Denn zunächst müssen ja Zellen die Virusproteine in Peptide zerlegen und sie auf ihrer Oberfläche präsentieren. Weil aber auch die T-Zellen ein Gedächtnis bilden, stehen sie bei einer erneuten Infektion schnell wieder auf der Matte und verhindern bei Menschen mit intaktem Immunsystem wohl zumindest einen schweren Verlauf.
Doch könnte SARS-CoV-2 durch Mutationen auch den T-Zellen entkommen? Dieser Frage ist in Wien ein Forscherteam unter Leitung von Andreas Bergthaler nachgegangen. Zunächst hatten sie gezielt nach mutierten Protein-codierenden Abschnitten in hunderten SARS-CoV-2-Genomen gesucht, die als Epitope an MHC-Klasse-I-Moleküle binden und damit als Antigen in Frage kommen. Auch die Österreicher fischten gezielt nach T-Zellen genesener COVID-19-Patienten, die zu den Antigenen passten. Die Autoren berichten von einer schlechteren Bindung der veränderten Antigene und einer verminderten Proliferation der CD8-T-Zellen. Auch Signale wie Interferon-gamma fielen schwächer aus (Sci. Immunol. 6(57): eabg6461).
Klar, in dieser Laborsituation hat man ganz gezielt Peptide mit veränderter Aminosäurefolge herausgepickt. Doch gerade auch die T-Zell-Antwort müsste SARS-CoV-2 unter einen Selektionsdruck setzen. Und was ist mit den Menschen in Manaus, die sich ein zweites Mal infiziert haben? Obwohl sie doch zumindest noch eine zelluläre Immunität haben sollten? „Das sind Fragen, auf die ich natürlich auch keine Antwort habe“, stellt Andreas Bergthaler klar, der in Wien am Research Center for Molecular Medicine (CeMM) die Arbeitsgruppe für Viruserkrankungen und Entzündungen leitet.
Den Ball flach halten
„Es ist ja noch immer umstritten, wie lange eine Immunität nach einer natürlichen Infektion wirklich anhält“, gibt Bergthaler zu bedenken. Mit den Ergebnissen, so betont er, wolle man auch nicht den Eindruck erwecken, als stünden T-Zell-Escape-Mutanten bereits in den Startlöchern. „Ob das nun für die Epidemie eine Rolle spielt, da würde ich den Ball eher flach halten; unsere Daten zeigen aber, dass SARS-CoV-2 prinzipiell zu solchen Mutationen in der Lage ist.“
Dass derzeit bei den Impfungen aber allein das Spike-Protein als Antigen dient, schränkt auch die Möglichkeiten der T-Zellen ein – besonders, wenn das Spike-Protein einem hohen Mutationsdruck unterliegt. „Für zukünftige Impfstoffe sollte man diskutieren, ob man neben dem Spike-Protein noch zusätzliche Antigene einbauen kann, um gezielt die T-Zell-Antwort zu verstärken“, schlägt Bergthaler vor.
Was die Dauer der Immunität betrifft, so scheint eine Impfung aber grundsätzlich nachhaltiger zu wirken als die natürliche Infektion. Hierzu wird es im Laufe des Jahres sicher zahlreiche Publikationen geben, und auch im Laborjournal werden uns SARS-CoV-2 und die T-Zellen wohl noch künftig begleiten.
Last Changed: 10.05.2021