Special Gene Editing
Krebs ade – dank Gene Editing?
von Sigrid März, Laborjournal 09/2017
Genverändernde Therapien stecken – zumindest in der humanen Anwendung – noch in den Kinderschuhen, erleben aber auch dank CRISPR wieder mehr Aufmerksamkeit. Stehen wir kurz vor dem Durchbruch?
Dank CRISPR ist Gene Editing in aller Munde. Die Heilung von Krebs, AIDS und allerlei genetischen Krankheiten scheint in greifbarer Nähe. Je nach Quelle liegen deshalb die Marktpotentialprognosen von CRISPR für die nächsten zehn Jahre zwischen fünf und acht Milliarden US-Dollar. Da wundert es nicht, dass sich auch Pharmaindustrie und Biotechunternehmen für die Gen-Schere interessieren.
Ganz vorne mit spielen natürlich die zahlreichen Firmen der CRISPR-Entdecker(innen) Emmanuelle Charpentier (jetzt MPI für Infektionsbiologie, Berlin), Jennifer Doudna (University of California, Berkeley) und Feng Zhang (Broad Institute, Massachusetts Institute of Technology). Ob klinische Forschung oder Landwirtschaft – es geht um Lizenzen, und dementsprechend um eine Menge Geld. Und so steht bereits seit einiger Zeit jedem der Start-ups mindestens ein großer Begleiter zur Seite, der sicherlich nicht nur unternehmerischen Ratschlag für die Lizenzgeber hat. Man darf mutmaßen, dass in dem Zusammenhang der ein oder andere Euro seinen Besitzer wechselte.
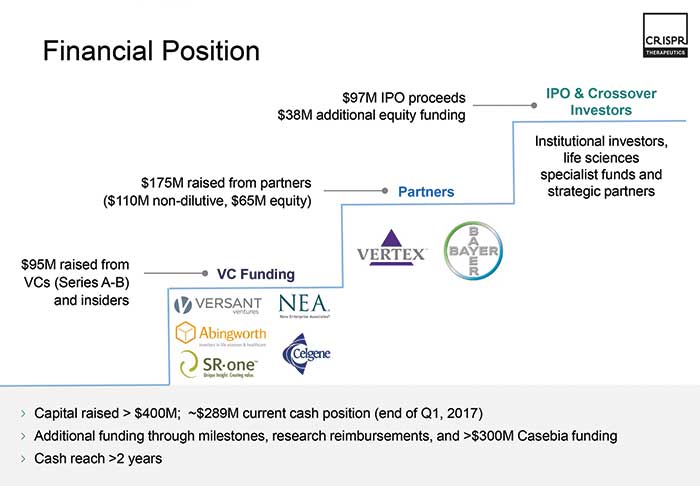
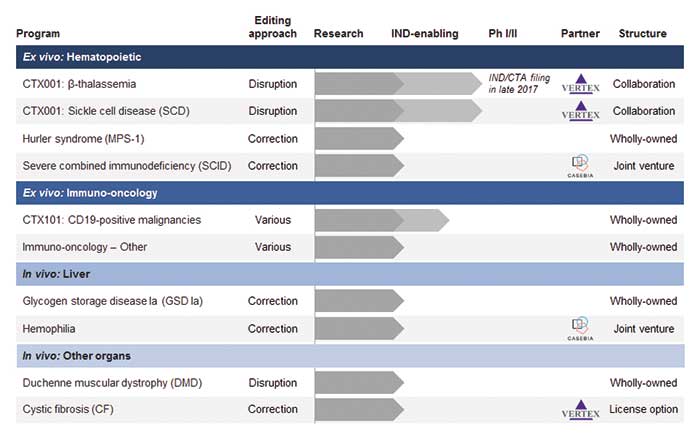
Die CRISPR Therapeutics AG (Basel), gegründet unter anderem von Charpentier und mit dem RNAi-Pionier Craig Mello im wissenschaftlichen Beirat, hat bereits 2015 gemeinsam mit Bayer (Leverkusen) das Joint Venture Casebia ins Leben gerufen. Man will möglichst bald neue Behandlungsmethoden für Blut- und Herzerkrankungen entwickeln. Zudem kooperiert das Basler Unternehmen mit Vertex Pharmaceuticals bei der Bekämpfung der genetischen Ursachen von Sichelzellanämie und zystischer Fibrose. Die zweite Charpentier-Firma ERS Genomics (Irland) hat sich DuPont Pioneer (USA) mit ins Boot geholt. Letztere halten dadurch Lizenzen auf die Vermarktung von CRISPR/Cas9-modifizierten landwirtschaftlichen Produkten wie trockenheitstolerantes Getreide oder besonders stärkehaltigen Mais. Auch Bayer hat bei ERS Genomics seine Finger im Spiel und sicherte sich Rechte für Forschungsutensilien, Zelllinien und Enzyme.
Ebenfalls aufs Feld zieht es Bayer Monsanto (Leverkusen/USA), die gemeinsam mit Editas Medicine und dem Broad Institute den CRISPR/Cas9-Nachfolger CRISPR/Cpf1 zum Genome Editing in der Agrarwissenschaft nutzen wollen. Intellia Therapeutics und Caribou Biosciences (USA, beide UC) gehen zusammen mit Novartis (Schweiz) immun-onkologische Ansätze an, um auf Einzelpersonen zugeschnittene Therapien zu entwickeln.
Ähnliche Geschäftspläne
Die Pipelines der klinisch-therapeutischen CRISPR-Startups zeigen dabei überraschend viele Überlappungen. Zum Beispiel wollen sowohl CRISPR Therapeutics als auch Editas Medicine Sichelzellanämie und Muskeldystrophie heilen. Frei nach dem Motto: Konkurrenz belebt das Geschäft? Zumindest herrscht zwischen den Firmen(inhabern) schon länger dicke Luft.
Da die Patentstreitigkeiten zwischen Charpentier, UC und Broad Institute nach wie vor nicht geklärt sind (siehe hierzu auch „CRISPR/Cas - sch(n)eiden tut weh“, Seite 50), stellt sich die Frage, ob potentielle Nutzer der Technologien demnächst zwei Lizenzen erwerben müssen. Sicher ist nur, dass zumindest alle therapeutischen Ansätze noch in den Kinderschuhen stecken und weit entfernt von einer Anwendung am Menschen sind; wenngleich sich Editas Medicine vor kurzem weit aus dem Fenster lehnte und versicherte, innerhalb der nächsten zwei Jahre eine CRISPR-basierte Therapie für eine seltene Augenkrankheit (Lebersche Kongenitale Amaurose, LCA) zu präsentieren.
Nicht der einzige Weg
CRISPR ist aber nicht die einzige Gene-Editing-Methode, die ihren Weg in die Humanmedizin sucht. Es ist noch gar nicht so lange her, da füllten Zinkfinger-Nukleasen (ZFN) die Nature-Artikel; ihnen wurde in der Gentherapie eine rosige Zukunft vorhergesagt (zum Beispiel hier: doi:10.1038/nature10177). Auch andere Designer-Endonukleasen wie Meganukleasen (modifizierte Homing-Endonukleasen ) und TALEN (Transcription Activator-like Effector Nucleases) reihen sich ein in die Truppe von Gene-Editing-Werkzeugen. Der molekulare Ablauf ist immer ähnlich: Nukleasen bewirken einen Doppelstrangbruch an definierter Stelle; während des zelleigenen Reparaturprozesses lassen sich Mutationen einbauen, zum Beispiel durch Deletion oder Insertion von Gen(abschnitt)en oder einzelnen Basen.
Während Meganukleasen wegen ihres komplexen Aufbaus keine große Rolle in der klinischen Forschung spielen, sind ZFN und TALEN mittendrin. Beide Technologien basieren auf nicht-spezifischen DNasen, die an sequenzerkennende Peptide gebunden sind. Dadurch sind sie einfacher zu konstruieren als Meganukleasen; zum Beispiel, um einen Mangel an Faktor IX zu reparieren. Dieser wird normalerweise in der Leber synthetisiert. Passiert dies nicht, ist die Blutgerinnung gestört (Hämophilie B).
Das 1995 gegründete US-Unternehmen Sangamo Therapeutics (Richmond, Kalifornien) strebte im Mai 2017 die erste Studie zum In-vivo-Genome-Editing an. Bisher wurden nur Zellen außerhalb des Körpers behandelt; erstmals sollen nun adeno-assoziierte Viren Hepatozyten aus dem Blut heraus infizieren und das mutierte Gen für den Faktor IX wiederherstellen. Zudem hat Sangamo 2009 begonnen, mittels ZFN einen Co-Rezeptor für HIV von T-Zellen und hämatopoetischen Stammzellen zu entfernen, um sie immun gegen das Virus zu machen.
Immuntherapien mit TALEN werden seit 2015 im Menschen getestet, allerdings bisher in nur sehr wenigen (genauer: zwei) Patienten. Einer davon war ein Baby mit Akuter Lymphatischer Leukämie (ALL). Entwickelt wurde diese „UCART19“ getaufte TALEN-Methode von der französischen Biopharmaziefirma Cellectis (Paris/New York). Dem kleinen Patienten wurden T-Zellen entnommen und modifiziert, sodass sie einerseits einen krebsspezifischen Rezeptor exprimieren (CAR-T, Chimeric Antigen Receptor) und andererseits resistent gegen das lymphodepletierende Krebstherapeutikum Alemtuzumab sind. Die derart veränderten T-Zellen wurden dem Baby injiziert, sodass sie ihrer Aufgabe – die Krebszellen zu attackieren – nachgehen konnten. Bis heute ist das Kind gesund.
Trotz Erfolg am Abgrund
Von diesem Erfolg hat Cellectis bislang allerdings nur wenig. Gebeutelt vom CRISPR-Hype, mussten die Franzosen 2013 beinahe Insolvenz anmelden. Erst Kooperationen mit den Pharmariesen Pfizer (USA) und Servier (Frankreich), einhergehend mit der Auslizensierung von UCART19, konnten das Unternehmen retten.
Einen anderen Weg gehen Rekombinasen, die allerdings in der Gene-Editing-Welt eher ein Schattendasein führen (ein Beispiel für eine Rekombinase in klinischer Anwendung schildert Frank Buchholz in LJ-online-Interview; erschienen am 14.09.2017). Der Ansatz ist hier weniger die Veränderung des humanen Genoms, sondern vielmehr die Wiederherstellung des Ursprungszustands zum Beispiel nach der Insertion viraler Gensequenzen aufgrund einer HIV-Infektion.
Bei aller Berechtigung für ZFN, TALEN & Co, CRISPR/Cas9 ist anders. CRISPR rockt. Daran lässt ein Blick in die Medien weltweit keinen Zweifel.
Das liegt an der Einfachheit des Systems. CRISPR/Cas lässt sich durch seinen modularen Aufbau (Nuklease + guide RNA; gRNA) in so gut wie jeder Spezies einsetzen, die für die Forschung interessant ist. Man denke nur an die Herstellung transgener Krankheitsmodelle in Tieren wie Schweinen oder Primaten, die dem Menschen ähnlicher sind als das Standardmodell Maus.
Die Entwicklung immer neuer Systeme überschlägt sich förmlich. Beispielsweise dead Cas9 (dCas9), eine katalytisch inaktive Cas9-Nuklease, die aber aufgrund der gRNA trotzdem an der Ziel-DNA bindet. Gekoppelt an Aktivierungsdomänen oder Repressoren eignet sich der Komplex zur Transkriptionsregulation; ein dCas9-Demethylase-Hybrid erlaubt epigenetische Modifikationen.
Da hilft es auch nicht, dass ZFN und TALEN weniger Off-Target-Effekte und eine höhere Spezialität nachgesagt werden. Einen Vorteil jedoch haben TALEN und ZFN: sie sind CRISPR in der therapeutischen Forschung zehn bis 15 Jahre voraus, was bei den langwierigen Zulassungsverfahren nicht zu vernachlässigen ist. Dennoch, CRISPR ist unschlagbar schnell und einfach zu bedienen, kostengünstig und flexibel. Während Forscher für die Konstruktion spezifischer ZFN und TALEN Erfahrung sowie Fachkenntnis in Molekularbiologie und Proteinengineering benötigen, kann sich jeder Laborhansel eine passende gRNA synthetisieren lassen. Firmen, die das nur allzu gerne erledigen, gibt es reichlich auf dem Weltmarkt, etwa Synthego (USA) und Eurofins (Frankreich). Generell hat sich die Unternehmenswelt zügig auf den wachsenden Bedarf an CRISPR-assoziierten Services und Reagenzien eingestellt: passende Transfektionsreagenzien gibt es beispielsweise bei PAN Biotech (Aidenbach) und Genaxxon Bioscience (Ulm); Biocat (Heidelberg), Metabion (Planegg), Eupheria (Dresden; siehe auch Firmenportrait auf Seite 52) sowie NEB (USA) bieten Kits, Reagenzien oder Enzyme rund um CRISPR an; Precision Biosciences (USA) ermöglicht mit ihrer DNE (Directed Nuclease Editor)-Technologie die Produktion von Genome-Editing-Enzymen; das US-Bioinformatik-Unternehmen Kbiobox hilft bei der Entwicklung präziser Gene-Editing-Werkzeuge; und Horizon Discovery (UK) haben Zelllinien für Forschung und klinische Anwendungen im Programm, an welchen zum Beispiel Resistenzen oder die therapeutische Aktivität von Substanzen getestet werden können.
Exponentionelle Paper-Zunahme
Der CRISPR-Hype schlägt sich auch in dem Mitteilungsbedürfnis der Forscher nieder. Während die Anzahl der Publikationen mit CRISPR-Hintergrund seit 2009 exponentiell zunimmt (alleine 2015 über tausend Veröffentlichungen), dümpeln ZFN und TALEN bei (weit) unter zweihundert herum. Täglich gibt es neue CRISPR-Meldungen sowie Nachweise, dass zelltherapeutische Ansätze im Experiment funktionieren, in Zellkultur wie auch im Tiermodell. Just im August 2017 gelang es Wissenschaftlern von der Oregon Health & Science University in Portland sogar, in menschlichen Embryonen einen Gendefekt zu reparieren, der im Zusammenhang mit der hypertrophen Kardiomyopathie steht (doi:10.1038/nature23305).
Bei all der Euphorie darf nicht vergessen werden, dass die routinemäßige Anwendung von Gene Editing in Patienten noch in ferner Zukunft liegt. In umfangreichen Studien muss sich erst einmal zeigen, inwieweit diese Methoden sich gegenüber bereits bestehenden Therapien behaupten können. Es gibt noch etliche Baustellen: die Spezifität muss besser und Off-Target-Effekte müssen reduziert werden; ein effizienter Transport des Editing-Komplexes zu den Zielzellen muss gewährleistet sein; die Reparaturmechanismen nach einem DNA-Doppelstrangbruch sind nach wie vor schwer steuerbar. Bisher gibt es zudem keine Studien zu möglichen Langzeitfolgen von Gene Editing im Menschen.
Diese Bedenken gelten sicherlich für alle Therapien, die das Genom des Menschen auf irgendeine Art und Weise beeinflussen; so auch für Therapien, die sich meist auf das Einbringen intakter Gene oder spezifischer Rezeptoren beschränken. Dennoch haben Gentherapien bereits ihren Weg in die Klinik gefunden. Laut einer Veröffentlichung des Journal of Gene Medicine (2017) sind momentan knapp 2.500 klinische Studien angemeldet, davon immerhin 93 in Phase III und drei in Phase IV (www.wiley.com/legacy/wileychi/genmed/clinical/). Zwei Drittel dieser zumeist virenbasierten Therapien knüpfen sich Krebszellen vor.
Im Juli 2017 zum Beispiel empfahl ein Beratungsausschuss der FDA, der US-amerikanischen Zulassungsbehörde für Medikamente und Co., die Zulassung einer von Novartis und der Universität Pennsylvania entwickelten Gentherapie gegen ALL. Den Patienten werden T-Zellen entnommen; diesen wird ein krebsspezifischer Rezeptor eingepflanzt und die modifizierten Zellen werden anschließend wieder ins Patientenblut zurück gegeben, wo sie im optimalen Fall die Krebszellen attackieren. Diese CAR-T-Zelltherapie ist eine vielversprechende Methode zur Bekämpfung bösartiger Leukämien. In der Regel wird eine solche Gentherapie aber erst in Betracht gezogen, wenn Standardtherapien mit Chemotherapeutika versagt haben.
Ein anderes Beispiel ist die Ex-vivo-Stammzelltherapie Strimvelis (GlaxoSmithKline), welche gegen die seltene, tödlich verlaufende Krankheit ADA-SCID (Severe Combined Immunodeficiency due to Adenosine Deaminase deficiency) entwickelt und bereits 2016 für den europäischen Markt zugelassen wurde. Ohne Adenosin-Desaminase (ADA) fehlen dem Blut reife Lymphozyten. Den jungen Patienten werden zuvor entnommene und mit einer intakten Kopie des ADA-Gens versehene Vorläuferzellen refundiert.
Am ehesten sind (schnelle) Erfolge von Gene Editing in der Agrarindustrie zu erwarten, denn die Behandlung von Tieren und Pflanzen mit artifiziellen Genen hat bereits eine längere Tradition, als dies beim Menschen der Fall ist. Der Vorteil des Gene Editing in der Pflanzen- und Tierzucht liegt auf der Hand: Mutationen lassen sich gezielt und somit mit weit weniger Zeitaufwand hervorrufen als mit konventionellen Zuchtmethoden. CRISPR/Cas ist bereits fester Bestandteil der modernen Nutztier- und -pflanzenzucht, und die Ideen gehen nicht aus: transgene Schweine, Nutztiere mit Resistenzen gegen virale Tierseuchen, Getreide mit mehr Nährstoffen und Toleranz gegen Trockenheit, ...
Die britische Nutztiergenetik-Firma Genus beispielsweise hat Schweinen mittels CRISPR/Cas das Membranprotein CD163 entfernt, welches eine Schlüsselrolle bei der Infektion durch das PRRS-Virus spielt. Die Tiere sind hernach resistent gegen das Reproduktions- und Atemwegssyndrom (Porcine Reproductive and Respiratory Syndrome), welches jährlich für empfindliche Verlust in der Schweinezucht verantwortlich ist.
Agrarindustrie schon weiter
Die konventionelle Getreidezüchtung ist mitunter kompliziert, weil die Pflanzen oft polyploid sind, das heißt, es müssen immer mehrere Allele berücksichtigt werden. CRISPR/Cas jedoch ist es egal, wie viele Chromosomenpaare eine Zelle hat. So lange die Erkennungssequenz vorhanden ist, wird geschnitten und modifiziert. Das macht Getreide zu einem dankbaren Ziel für Gene Editing. So überrascht es nicht, dass mittels CRISPR und TALEN mehltauresistente Weizensorten generiert werden (doi:10.1038/nbt.2969). Die US-Firma Calyxt (ehemals Cellectis Plant Science) baut einen solchen Weizen bereits in Freilandversuchen an. Außerdem probiert Calyxt sich an Soja und Kartoffeln. Das UK-Start-up Aranex hingegen plant, mittels CRISPR die Erdnuss von bekannten Allergenen zu befreien.
Ob CRISPR sich in der Agrarindustrie in Europa auf Dauer halten kann, hängt auch davon ab, ob CRISPR-behandelte Pflanzen und Tiere als gentechnisch veränderte Organismen (GVO) eingestuft werden oder nicht, und dementsprechend genehmigungsfrei wären. Die USA haben entschieden: keine GVO. Europa zaudert noch.
Die Argumente: Es werde keine Fremd-DNA eingeführt, eine durch CRISPR/Cas eingeführte Mutation hätte auch zufällig entstehen können. Damit stünden die mittels Gene Editing entstandenen Kreaturen in einer Reihe mit denen konventioneller Züchtung, ergo keine GVO. Ob die Verbraucher des CRISPR-Getreides das allerdings genauso sehen, ist fraglich. Gerade in Europa sind die Bedenken gentechnisch veränderten Lebensmitteln gegenüber nach wie vor hoch. Das musste zum Beispiel auch BASF Plant Science erfahren, die sich nach ewigem Hickhack (Zulassung, Klage, zerstörte Versuchsfelder) 2012 mit ihren Genkartoffeln Fortuna und Amflora vom europäischen Markt verabschiedeten.