Zelluläres Aufrüsten -
Im Gespräch mit Evelyn Ullrich
Das Interview führte Juliet Merz, Laborjournal 05/2021
(10.05.2021) Evelyn Ullrich ist Internistin, Immunologin und seit 2012 Professorin für Zelluläre Immunologie am Universitätsklinikum Frankfurt am Main, wo sie mit ihrem Team vorwiegend Zell- und andere Immuntherapien zur Behandlung von Krebserkrankungen entwickelt. Im Interview verrät sie, wie Genmodifikationen von Immunzellen im Laufe der Zeit konzipiert wurden und warum gerade die CAR-Technologie so vielversprechend ist.
Laborjournal: In den 1960er-Jahren entdeckten Wissenschaftler den Thymus als Ursprung von T-Zellen, 1975 beschrieben sie erstmals natürliche Killerzellen (NK-Zellen). Wann haben Forscher begonnen, Immunzellen zu Therapiezwecken genetisch zu modifizieren?
Evelyn Ullrich » Die Anfänge der Zelltherapie liegen in den 1980er-Jahren. 1986 war es Baseler Immunologen um Michael Steinmetz gelungen, die murinen Gene für die Alpha- und Beta-Ketten von T-Zellrezeptoren von einer zytotoxischen T-Zelle in eine andere T-Zelle zu übertragen [Nature 320(6059): 232-8]. Die Expression der transfizierten Alpha- und Beta-Gene verlieh der Empfängerzelle die Spezifität der Spenderzelle. Die Entwicklung des ersten CARs, also eines chimären Antigenrezeptors, erfolgte 1993 durch ein israelisches Team um Zelig Eshhar [J. Immunol. 151: 6577-82].
Wie die CAR-Technologie genau funktioniert, haben wir bereits an anderer Stelle ausgiebig besprochen (siehe Stichwort LJ 3/2018, Seite 36, Link). Können Sie unseren Lesern dennoch kurz die wichtigsten Infos zusammenfassen?
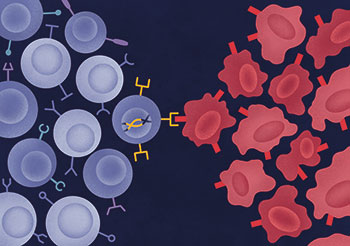
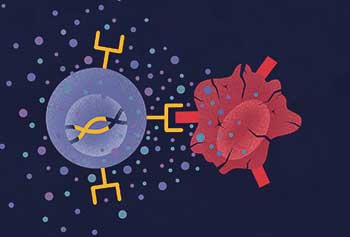
Ullrich » Die CAR-Technologie dient letztendlich dazu, T-Zellen oder andere Immunzellen so zu aktivieren, dass sie Antigen-spezifisch fremde oder entartete Zellen erkennen und lysieren können. Dafür wird dem Patienten Blut entnommen, um daraus zum Beispiel nur die T-Zellen zu isolieren. Über einen viralen Vektor oder andere Verfahren gelangt genetische Information für einen CAR in die Immunzelle, die diesen dann auf ihrer Oberfläche exprimiert. Die somit genetisch modifizierten CAR-T-Zellen werden anschließend dem Patienten ins Blut zurück infundiert, wo sie mit ihren CARs spezifische Antigene erkennen können, beispielsweise Oberflächenproteine von Krebszellen.
Welche Schwierigkeiten gibt es bei der CAR-T-Zell-Therapie aktuell noch?
Ullrich » Bei den ersten Therapien mit CAR-T-Zellen, die 2011 bei Patienten mit B-Zell-Leukämien durchgeführt wurden, ist aufgefallen, dass die Patienten sehr starke Immunreaktionen in Form einer Cytokin-Freisetzung hatten – das sogenannte Cytokine Release Syndrome. Das Immunsystem der Patienten hatte massiv Cytokine ausgeschüttet und damit allgemeine Entzündungs-, Fieber- und/oder Sepsis-Symptome verursacht. Schuld daran sind weitestgehend die beiden Interleukine IL-1 und IL-6. Mittlerweile hat man verstanden, wie man diesem Syndrom sowohl vorbeugt als auch sehr rasch und gezielt mit therapeutischen Antikörpern entgegenwirkt, wie zum Beispiel dem IL-6-bindenden Tocilizumab. Deshalb stellt das Cytokine Release Syndrome keine ganz so große Gefahr mehr dar.
Je weiter fortgeschritten die Erkrankung ist, desto schwieriger ist es jedoch, dass dieser Patient die Therapie ohne Folgeschäden verkraftet. Wir versuchen deshalb, die Immunzellpräparate dahingehend zu modifizieren, dass das Cytokine Release Syndrome gar nicht erst ausgelöst wird.
In einem fortgeschrittenen Stadium einer Krebserkrankung ist es vermutlich auch schwieriger, überhaupt an ausreichend Immunzellen heranzukommen, oder?
Ullrich » Richtig. Patienten, die spezifische Zelltherapien erhalten, haben meistens nicht gut auf die Standardtherapien angesprochen oder einen Rückfall erlitten. Sie haben häufig schon mehrere Chemotherapie-Behandlungen hinter sich, manche hatten sogar eine Stammzelltransplantation oder eine Immuntherapie mit Antikörpern. Das Immunsystem dieser Personen ist oftmals so geschwächt, dass sowohl die Zahl der gewonnenen T-Zellen vermindert sein kann als auch ihre Funktionalität. Häufig lassen sich die Patienten-eigenen Zellen nicht mehr gut in Kultur vermehren – wir reden von der verminderten Proliferationskapazität der T-Zellen. All diese Faktoren senken die Wahrscheinlichkeit, ausreichend gentechnisch veränderte Immunzellprodukte, also etwa CAR-T-Zellen, zu generieren.
Und in einem solchen Fall können Sie nicht die Immunzellen eines Spenders verwenden?
Ullrich » Bei T-Zellen eines fremden Spenders besteht die Gefahr, dass diese auch gesundes Gewebe im Empfänger angreifen. Der Grund dafür ist das Humane Leukozyten-Antigen-System (HLA-System), auf das die körpereigenen T-Zellen abgestimmt sind. Bei einer Transplantation ist es wichtig, dass sich die HLA-Merkmale von Spender und Empfänger ähneln. Wenn nicht, kann es nicht nur zu einer Abstoßungsreaktion des Transplantats kommen, sondern auch zu der sogenannten Graft-versus-Host(GvH)-Reaktion, bei der alloreaktive Spender-Immunzellen die Organe des Empfängers schädigen. Diese Reaktion kann lebensbedrohlich sein, weil prinzipiell jedes Organ durch alloreaktive T-Zellen angegriffen werden kann. Deshalb können wir nicht einfach die T-Zellen eines x-beliebigen Knochenmark- oder Stammzellspenders verwenden, um einen Krebspatienten zu behandeln. Man kann allerdings statt T-Zellen andere Immunzellen für die CAR-Therapie in Betracht ziehen, bei denen die GvH-Problematik eine untergeordnete Rolle spielt.
... und da kommen die NK-Zellen ins Spiel.
Ullrich » Im Gegensatz zu T-Zellen, die Tumorantigene T-Zellrezeptor-MHC-vermittelt erkennen, können NK-Zellen durch das intrinsisch angelegte Rezeptor-Spektrum auf ihrer Oberfläche „selbst“ von „nicht-selbst“ unterscheiden und dabei prinzipiell fremde, maligne entartete oder Virus-befallene Zellen eliminieren. Sie verfügen über ein ganz ausgeklügeltes System an aktivierenden und inhibierenden Rezeptoren auf ihrer Oberfläche, welches die Immunantwort steuert.
Vorteil dabei ist, dass NK-Zellen an sich nicht die Gefahr einer GvH-Reaktion bergen. Das heißt, auch wenn wir NK-Zellen eines beliebigen Spenders nehmen – wir nennen das off the shelf – gibt es keine Immunreaktion gegen Organe des Empfängers. Gleichzeitig vermehren sich natürlicherweise NK-Zellen im Zuge der Immunantwort sehr früh und haben eine intrinsische Zytotoxizität.
Welche Vorteile bieten die CAR-NK-Zellen gegenüber den T-Zellen?
Ullrich » Die CAR-Technologie gekoppelt mit NK-Zellen bringt einen entscheidenden Vorteil: Zum einen erkennen CAR-NK-Zellen über die chimären Antigenrezeptoren spezifische Tumorantigene auf den Krebszellen, darüber hinaus bleibt die natürlicherweise vorhandene Zytotoxizität gegen entartete Zellen bestehen. Damit haben wir mit CAR-NK-Zellen sogar bei Tumorzellen eine Chance, die, um dem Immunsystem zu entkommen, ein spezielles Tumorantigen herunterreguliert haben, gegen das der CAR eigentlich gerichtet ist. Die von Natur aus angelegten Eigenschaften der NK-Zellen erkennen die Tumorzelle dennoch als gefährlich, und sie wird lysiert. Damit haben wir quasi ein Augenpaar mehr, das aufpasst.
Durch das Herunterregulieren von Antigenen versucht die Tumorzelle dem Immunsystem zu entkommen. Ihre Aufgabe als Forscher ist es also, dem Immunsystem dabei zu helfen, Tumorzellen trotzdem zu entlarven?
Ullrich » Wir versuchen, die Immunzellen aufzurüsten. Bei der NK-Zelle hilft uns, dass die unspezifische Erkennung von malignen Zellen auch noch da ist. Einen weiteren wichtigen Ansatzpunkt haben Sie bereits in einem früheren Interview mit Toni Cathomen angesprochen [LJ 9/2017, Seite 42, Link]. In Kooperation mit ihm und anderen Wissenschaftlern arbeiten wir derzeit daran, zusätzlich zum Einschleusen der CARs, inhibitorische Faktoren in den Immunzellen mithilfe von CRISPR/Cas9 auszuknocken oder herunterzuregulieren. Denn Tumore versuchen nicht nur, dem Immunsystem zu entkommen, sie sabotieren gleichzeitig die Arbeit der Immunzellen, indem sie inhibitorische Faktoren aussenden und damit die Aktivität der Immunzellen eindämmen.
Gibt es noch weitere Ansätze, wie das Immunsystem im Kampf gegen Krebszellen unterstützt werden kann?
Ullrich » Zur Unterstützung können wir auch Gene für die Produktion von Cytokinen in die Immunzellen einbringen, damit sie sich im Körper optimal vermehren können. Die Cytokine spielen eine wichtige Rolle für das Überleben und die Aktivität der Immunzellen. Mittlerweile haben Forscher die CAR-Technologie so weiterentwickelt, dass wir quasi die vierte Generation von CAR-T-Zellen haben, die sogenannten TRUCKs. Die Abkürzung steht im Englischen für „T cells Redirected for Universal Cytokine-mediated Killing“. Sie produzieren bei Antigen-Kontakt selbst Cytokine und steigern dadurch ihre Zytotoxizität und Proliferation.
Was Sie gerade über CAR-NK-Zellen berichtet haben, klingt sehr vielversprechend. Wo stößt diese Technologie bislang an ihre Grenzen?
Ullrich » Die Entdeckung der NK-Zellen liegt gut fünfzehn Jahre hinter den T-Zellen, und auch die Entwicklung von Genmodifikationen in NK-Zellen ist noch jüngeren Datums als die in T-Zellen. Im Feld der Genmodifikationen von NK-Zellen besteht deshalb noch Nachholbedarf. Lange Zeit war eine Hürde problematisch, die wir jetzt mit der Entwicklung neuer Technologien nehmen konnten. Ich habe ja vorhin erzählt, dass sich NK-Zellen im Rahmen der natürlichen Immunantwort früh vermehren und Virus-befallene Zellen als gefährlich erkennen und eliminieren. Und genau deshalb besitzen NK-Zellen die Eigenschaft, dass sie sich selbst nicht gerne von Viren infizieren lassen. Das heißt, wir müssen mit einer gewissen Raffinesse vorgehen, um sie genetisch überhaupt modifizieren zu können. Die Protokolle für die Transduktion von T-Zellen können nicht einfach für die Generierung von CAR-NK-Zellen übernommen werden. Vergangenes Jahr haben wir herausgefunden, dass NK-Zellen sich besser durch Alpha-Retroviren als durch Lentiviren transduzieren lassen [Front. Immunol. 10: 3123]. NK-Zellen besitzen auf ihrer Oberfläche Eintritts-Rezeptoren, die das Transduzieren über spezifische pseudotypisierte Retroviren ermöglichen. T-Zellen sind da unkomplizierter.
Was bei beiden Zellpopulationen gut funktioniert und gerade weiterentwickelt wird, sind nicht-virale Transduktionsmöglichkeiten – zum Beispiel über Nukleofektion und Sleeping-Beauty-basierte Transposition.
Wie funktionieren diese Methoden?
Ullrich » Nukleofektion ist ein auf der Elektroporation basierendes physikalisches Verfahren, um genetisches Material in den Zellkern der Immunzelle einzubringen. In Kombination mit der von Zoltán Ivics entwickelten Sleeping-Beauty-Transposon-Technologie ist die Nukleofektion ein Verfahren, mit dem wir nicht nur genetische Information in Form kleiner Mini-Circle-DNA einschleusen können, sondern auch ein Enzym, die sogenannte Transposase, um das Genom zu schneiden, sodass die gewünschte DNA-Sequenz eingebaut werden kann.
Diese Verfahren zur genetischen Modifikation von Immunzellen sind im Übrigen äußerst sicher. Die von den Patienten stammenden Immunzellen werden in Kultur verändert und anschließend sämtliche Partikel – egal ob Plasmide oder Viren – entfernt. Weitere Modifikationen der Zellen können so nicht mehr stattfinden und nur die spezifisch veränderten Immunzellen gelangen in den Körper des Patienten.
Wo geht zukünftig die Reise mit der CAR-Technologie hin?
Ullrich » Für eine effektive Therapie ist es wichtig, dass die Immunzellen im Patienten persistieren, also längerfristig überleben. T-Zellen bieten den Vorteil von einer klonalen Proliferation: So lange Antigen vorhanden ist, wird die Vermehrung der Zellen stimuliert. In der T-Zell-Therapie entsteht hierdurch ein Balanceakt. Man muss die T-Zellen in Schach halten, damit keine übermäßige Immunreaktion droht. Gleichzeitig profitiert der langfristige Behandlungserfolg von der Aktivität und dem Persistieren der Immunzellen, insbesondere von Gedächtniszellen. Sobald wieder maligne entartete Zellen mit dem CAR-spezifischen Antigen auftauchen, können diese auch noch Jahre später aussortiert werden.
Und wie ist das bei den NK-Zellen?
Ullrich » Hier arbeiten wir derzeit an anderer Stelle daran, die Immunzell-Persistenz zu optimieren. Dank einer Studie aus dem vergangenen Jahr sind wir zuversichtlich. Eine US-amerikanische Gruppe vom MD Anderson Cancer Center der University of Texas hat erstmals CD19-CAR-NK-Zellen zur Behandlung von Patienten mit refraktären oder rezidivierten B-Zell-Lymphomen eingesetzt und auch noch einige Monate nach der Verabreichung spezifische CAR-NK-Zellen im Blut der Patienten detektiert (N. Engl. J. Med. 382(6): 545-53).
Wie haben die Kollegen aus den USA das geschafft?
Ullrich » Sie haben die NK-Zellen genetisch so modifiziert, dass sie nicht nur den CD19-CAR exprimieren, sondern auch Interleukin-15 selbst produzieren, das ein Schlüssel-Cytokin für das Überleben der NK-Zellen ist.
In unserer „Wirkstoff-des-Monats“-Serie haben wir in Ausgabe 3/2020 bereits kommerziell erhältliche CAR-T-Zell-Produkte vorgestellt (Link). Die bekanntesten sind wohl Kymriah und Yescarta zur Behandlung von Leukämien oder B-Zell-Lymphomen. Mittlerweile gibt es vier von der US-amerikanischen Food and Drug Administration (FDA) zugelassene kommerziell erhältliche CD19-CAR-T-Zell-Produkte. CAR-NK-Zell-Therapien hingegen befinden sich aktuell noch in der Warteschleife, oder?
Ullrich » Richtig, während es derzeit weltweit über 500 klinische Phase-1- und -2-Studien zur Evaluation von CAR-T-Zell-Produkten gibt, sind es gerade mal um die zwanzig Studien mit CAR-NK-Zell-Produkten. Die meisten davon werden in China oder den USA durchgeführt.
In Deutschland gibt es derzeit insgesamt an die dreißig CAR-Zell-Therapie-Studien zur Behandlung von B-Zell-Neoplasien, Leukämien und dem Multiplen Myelom.
[In einem Übersichtsartikel haben Ullrich et al. kürzlich die aktuelle Studienlage zu CAR-T- und CAR-NK-Zell-Therapien in Deutschland zusammengefasst: Gene Ther., doi: 10.1038/s41434-021-00246-w.]
Gibt es denn noch andere Erkrankungen, die sich mit CAR-Zellen behandeln lassen? Gerade NK-Zellen sind im Körper ja dafür zuständig, nicht nur Tumorzellen zu erkennen, sondern auch Pathogen-befallene Zellen.
Ullrich » Genau diese Idee verfolgen Forscher derzeit. Es gibt beispielsweise erste Ansätze, mit CAR-T-Zellen HIV-infizierte Zellen zu behandeln (Rev. Med. Virol. 30(6): 1-14) – das ist auch für NK-Zellen denkbar. Brandaktuell werden derzeit auch CAR-Immunzell-Präparate entwickelt, um SARS-CoV-2-befallene Zellen zu eliminieren.
Außerdem versuchen wir weitere solide Tumore in den Fokus zu nehmen. Ein Hindernis besteht aktuell darin, die genetisch modifizierten Immunzellen zum Tumor zu manövrieren. Natürlich ist es viel einfacher, leukämische Zellen im Blut oder Knochenmark zu behandeln, die man über eine Infusion leicht erreichen kann.
Wie kann diese Hürde genommen werden?
Ullrich » Die Immunzellen können gentechnisch so verändert werden, dass sie Chemokinrezeptoren exprimieren, die dann die Migration hin zu den befallenen Organen und dem Tumor ermöglichen. Das ist je nach Tumorart mal einfacher, mal schwieriger.
Die CAR-Technologie kommt derzeit hauptsächlich bei T- und NK-Zellen zum Einsatz. Gibt es noch andere Anwärter?
Ullrich » T- und NK-Zellen sind quasi die zwei Haupt-Immunzell-Gruppen für das direkte Erkennen und Eliminieren von Tumorzellen. Es gibt zusätzlich noch Immunzell-Präparate, die man aus peripherem Blutgemisch, sogenannten PBMCs, durch die Zugabe von Cytokinen und Antikörpern in vitro generieren kann – sie heißen Cytokin-induzierte Killerzellen. Die Protokolle dazu sind schon seit 1993 etabliert und werden regelmäßig in unterschiedlichen klinischen Studien zur Therapie von hämatologischen Erkrankungen eingesetzt. Und auch diese werden jetzt mit CARs modifiziert.
Außerdem gibt es weitere natürlicherweise vorkommende Subpopulationen, die mit T- und NK-Zellen verwandt sind, wie zum Beispiel NK-T-Zellen oder γ/δ-T-Zellen, die interessante immunologische Eigenschaften haben und mit CARs aufgerüstet werden können.
Wie sieht die Therapie mithilfe genmodifizierter Immunzellen von morgen aus?
Ullrich » In Zukunft wird sich wahrscheinlich je nach Tumorentität eine Empfehlung ergeben, welches Zell-Therapie-Protokoll am sinnvollsten ist. Dabei können je nach Erkrankung entweder T-Zell- oder NK-Zell-basierte Therapien erfolgversprechender sein. Außer der CAR-Technologie kann ich mir gut vorstellen, dass wir zukünftig auch Genome Editing einsetzen, um inhibitorische Faktoren durch CRISPR/Cas9 zu eliminieren oder zu unterdrücken. Darüber hinaus erweisen sich Kombinationstherapien mit Checkpoint-Inhibitoren oder anderen immunmodulatorischen Medikamenten in ersten Studien als vielversprechend. Ich denke, wir werden im Rahmen der personalisierten Medizin weiterhin einen multimodalen Ansatz brauchen, der aber im Gegensatz zur konventionellen Chemotherapie zukünftig deutlich nebenwirkungsärmer für die Patienten sein kann.
Last Changed: 10.05.2021