Mitnichten leblos
ORGANOIDE
von Henrik Müller, Laborjournal 05/2020
(08.05.2020) Die 3D-Zellkultur von Organmodellen ist ihren biotechnologischen Kinderschuhen entwachsen. Wie weit werden sie der Komplexität und genetischen Heterogenität höherer Organismen gerecht?
Die Vorteile von Organoiden liegen auf der Hand. Die Miniorgane verbessern die Aussagekraft von Pharmakologie- und Toxikologie-Assays, helfen bei der Erforschung von Organentwicklung oder Krankheitsmechanismen und dienen in Zukunft womöglich sogar als autologe Ersatzorgane. Abgesehen davon, dass sie ethische Probleme mildern können – etwa indem sie Tierversuche ersetzen.
Augenblicklich stellen Organoide eine Art Königsweg dar, die zelluläre Mikroumgebung von Gewebe ex vivo in seiner Gesamtheit zu rekapitulieren, und zwar leicht zugänglich und manipulierbar. Wie immer lauert der Teufel aber im Detail. Denn so vielfältig ihre Einsatzmöglichkeiten sind, so komplex sind Organoide auch – was kaum wundert, da sie ja schließlich die Vielfalt unterschiedlicher Gewebe des menschlichen Körpers nachbilden sollen. Nicht zuletzt deshalb ist selbst ihre Definition derzeit noch im Wandel begriffen (siehe Infokasten).
Alte Bekannte aus der Zellkultur
Doch hier soll eher die Praxis Thema sein. Normalerweise sind eine Reihe bestimmter Pufferkomponenten und Wachstumsfaktoren häufig Bestandteil gebräuchlicher Nährmedien wie etwa Advanced Dulbecco’s Modified Eagle‘s Medium (AdDMEM). Dazu zählen beispielsweise HEPES, N-Acetyl-L-Cystein und epidermaler Wachstumsfaktor (EGF). AdDMEM selbst ist dank seines verringerten Zusatzes an fetalem Kälberserum kein Unbekannter in der Säugerzellkultur, HEPES stabilisiert den pH-Wert, N-Acetyl-L-Cystein schützt Zellen als Vorstufe von Glutathion vor freien Radikalen und EGF stimuliert schließlich die Ausbildung einer Reihe von Stammzellen.
Verwirrende Vielzahl
Doch das ist bereits der Punkt, an dem es kompliziert wird. Je nach Ursprung verwendeter Ausgangszellen und je nach Art des Zielgewebes kommen unterschiedliche Wachstumsfaktoren zum Einsatz. Beispielsweise differenzierte die Gruppe um Hans Clevers vom Utrechter Hubrecht-Institut für Entwicklungsbiologie und Stammzellforschung Hepatozyten-Organoide aus adulten Stammzellen durch Zugabe von EGF, FGF10, HGF, Noggin, BMP7 und FGF19 (Cell 160(1-2): 299-312). Das Gleiche gelang jedoch Takanori Takebe und Kollegen an der Yokohama City University Graduate School of Medicine aus pluripotenten Stammzellen in RPMI1640-Medium anstelle von AdDMEM sowie mittels BMP4, VEGF, Activin, PDGF-BB und FGF2 (Cell Rep. 21(10): 2661-70). Ganz klar stellen Nährstoffmedien für komplexe Kulturen mehrerer Zelltypen eine der zukünftigen Herausforderungen dar. Die Vielzahl an Wachstumsfaktoren, die beispielsweise ein Review vom University of Nebraska Medical Center für die Herstellung verschiedener Organoide aufzählt, muss einen auf den ersten Blick förmlich erschlagen (Stem Cells 36: 1329-40).
Ein wenig Ordnung in das Durcheinander bringt die folgende Unterteilung. Adulte Stammzellen können bisher in gastrale und intestinale Organoide differenziert werden – wie auch in solche für Leber, Pankreas, Speicheldrüsen und Zunge. Der Wnt-Signalweg der Embryogenese spielt hier eine Schlüsselrolle. Embryonale und induzierte pluripotente Stamm (iPS)-Zellen können dagegen zu entodermalen und ektodermalen Geweben differenziert werden – also zu Geweben des Verdauungstrakts, der Atemwege und deren Epithelien, zu Schild-, Bauchspeichel- und Thymusdrüsen, zu Niere, Herz und Leber beziehungsweise zu Innenohr, Retina und Gehirn.
Derartige Vielfalt spiegelt sich natürlich auch in den damit beschäftigten Arbeitsgruppen wider, selbst an ein und demselben Wissenschaftsstandort. Im Herbst 2019 etablierte beispielsweise das Max-Delbrück-Centrum (MDC) für Molekulare Medizin in Berlin eigens eine Technologie-Plattform für Organoide unter der Leitung von Agnieszka Rybak-Wolf. Während ihre eigene Arbeitsgruppe das Transkriptom gesunder und kranker Organoide analysiert, verwendet sie selbst einen erheblichen Anteil ihrer Arbeitszeit auf Kooperationspartner der Plattform. So leitet sie zusammen mit dem Neuropathologen Frank Heppner von der Charité – Universitätsmedizin Berlin Therapiemöglichkeiten aus Alzheimer-Organoiden ab. Zudem untersucht sie gemeinsam mit dem RNA-Biochemiker Markus Landthaler, wie sich virale Infektionen auf die Entwicklung von Gehirnorganoiden auswirken. Mit dem Entwicklungsbiologen Kai Schmidt-Ott erforscht sie renale Erkrankungen, zusammen mit der Stammzellbiologin Mina Gouti das neuromuskuläre System. Eine Schlüsseltechnologie stellen Organoid-Kulturen überdies auch für das EU-weite Forschungsprojekt LifeTime dar, das von Nikolaus Rajewsky, dem Direktor des Berliner Instituts für Medizinische Systembiologie am MDC, co-koordiniert wird.
Stefan Liebau, Direktor des Instituts für Neuroanatomie & Entwicklungsbiologie der Eberhard Karls Universität Tübingen, geht schon einen Schritt weiter: „Sich leichter regenerierende Systeme wie Leber-Organoide wird die Forschungsgemeinde vielleicht schon in naher Zukunft an gut vaskularisierte Stellen des menschlichen Körpers verpflanzen können. Das Gleiche gilt etwa für Langerhans-Inseln der Bauchspeicheldrüse, die – unter die Haut verpflanzt und ans Blutgefäßsystem angeschlossen – Insulin produzieren könnten. Bei Organoiden, in denen eine Vernetzung wie etwa mit Synapsen unwesentlich ist, ist die Forschung extrem weit.“
Wenig strukturierte Minihirne
Das überrascht nicht, schließlich besteht die Leber fast nur aus zwei epithelialen Zelltypen, nämlich Hepatozyten und duktalen Zellen. Beide können schon länger aus embryonalen und iPS-Zellen differenziert werden. Trotzdem bringen Leber-Organoide stellvertretend für alle 3D-Zellkulturen entscheidende Vorteile mit sich. Denn sie überwinden genetische und epigenetische Kursabweichungen während der Reprogrammierung von Stammzellen und ermöglichen so erst eine native Gewebemorphologie.
Das ehrgeizigste Ziel stellen wahrscheinlich cerebrale Organoide dar. Zwar wachsen sie wie ihre nicht-cerebralen Geschwister bislang nur wenige Millimeter groß und verfügen weder über Strukturen höherer Ordnung wie Gyri und Sulci noch über myelinisierte Axone. Dennoch können Gruppen wie etwa diejenige um Jürgen Knoblich am Institut für Molekulare Biotechnologie in Wien in ihnen bereits neuronale Calciumwellen und postsynaptische Aktionspotentiale induzieren; sie können Mikroglia und Neuroepithelien entstehen lassen; und sie können 3D-Organmodelle unterschiedlicher Hirnregionen fusionieren, um anterior-posteriore und dorsal-ventrale Direktionalität zu erzeugen (Nat. Methods 14(7): 743-51). Ein Interview mit dem Organoid-Spezialisten Knoblich findet sich in Laborjournal 10/2017 auf Seite 65.
Der Neurowissenschaftler Rusty Gage und sein Team am Salk Institute for Biological Studies in La Jolla, USA, verpflanzten cerebrale Organoide kürzlich in Mäuse (Nat. Biotechnol. 36: 432-41). Das angrenzende murine Hirn versorgte die Organoid-Transplantate daraufhin mit Blutgefäßen und verknüpfte sie mit Synapsen, über welche die Forscher optogenetische Signale zwischen Transplantat und Wirtshirn weiterleiten konnten. Die neuronalen Netzwerke der Hirnchimären umfassten also Zellen menschlichen und murinen Ursprungs.
Die zwei bis drei Millionen Zellen cerebraler Organoide sind nur ein schwacher Abglanz der Möglichkeiten des menschlichen Gehirns mit seinen 86 Milliarden Neuronen. Trotzdem wirft derartige Forschung eine Reihe Medizin-ethischer und -rechtlicher Fragen auf. Ein Team um Hans‐Georg Dederer, Lehrstuhlinhaber für Staats-, Völker- und Internationales Wirtschaftsrecht an der Universität Passau, erarbeitet gegenwärtig einen Rechtsrahmen zur Anwendung genomeditierter Gehirn-Organoide. Auf Seite 42 steht er Laborjournal Rede und Antwort (Link).
Das Geheimnis der Züchtung von Organoiden liegt neben der Auswahl geeigneter Stammzellen und einer gekonnten Zugabe der richtigen Wachstumsfaktoren zum richtigen Zeitpunkt auch in der Zellkultur-Umgebung. Standardisiert ist laut Liebau auch da wenig: „Für die Wahl der Herstellungsmethode ist die Art des herzustellenden Organoids entscheidend. Meist gibt es Protokolle mit und ohne Matrigel, die sich hauptsächlich in den Zeiten von Adhäsion und Suspension der wachsenden Organoide unterschieden.“
Die Markennamen Matrigel, Basement Membrane Extract (BME) oder EHS-Matrix beschreiben eine gelatineartige, heterogene Wachstumsgrundlage aus Interzellularsubstanzen wie Laminin, Kollagen Typ IV, Entactin, Fibronectin und Heparansulfat-Proteoglykanen. Sie wird aus dem Sekret der murinen Sarkom-Zelllinie Engelbreth-Holm-Swarm (EHS) gewonnen und gibt Organoid-Zellen den rechten Grad an Halt, den sie auch in vivo über Integrin- und Selectin-Rezeptoren aus dem Interzellularraum spüren.
Unvollständige Simulationen
„Interzellularsubstanzen bringen leider entscheidende Nachteile mit sich“, fährt Liebau fort. „Aufgrund ihres murinen Ursprungs verringern sie die Kompatibilität von Transplantaten. Sie beschränken das Oberflächen-zu-Masse-Verhältnis herstellbarer Organoide. Vor allem gestalten sie den Medienwechsel und die Zellentnahme schwieriger.“
Als besser definierte Matrigel-Alternativen kommen synthetische Polymere wie Polyethylenglykole oder Polyacrylamide sowie natürliche Polymere wie Integrin-bindende Arg-Gly-Asp-Polypeptide zum Einsatz. Auch sie können die räumlich-zeitlichen Zell-Zell- und Zell-Matrix-Wechselwirkungen echter Gewebe jedoch bisher nur unvollständig simulieren.
Verblüffende Selbstorganisation
Eine weitere Aussage des Entwicklungsbiologen Liebau überrascht vielleicht am meisten: „Nach unserer Erfahrung bedürfen 3D-Organmodelle meist weniger externer Modulation der Wachstumssignale als 2D-Zellkulturen.“ Damit spricht er den Kernpunkt der Organoid-Forschung an, deren Gewicht nicht genug betont werden kann: Selbstorganisation.
Liebaus Mitarbeiter arbeiten an olfaktorischen, otischen und retinalen Organoiden. Am Beispiel von letzteren erklärt er: „iPS-Zellen reprogrammieren wir aus Haar-Keratinocyten und differenzieren sie dann entlang neuraler Signalwege, die das ektodermale Keimblatt verstärken. Ab da läuft vieles von selbst. Das sogenannte Augenfeld der embryonalen Augenentwicklung generiert sich – wir lösen es ab und geben es in eine Suspensionskultur, in der sich von alleine retinale Zellen entwickeln.“ Denn in den meisten Fällen sind in Organoiden verschiedene Signalkaskaden von selbst aktiv und rekapitulieren die Embryonalentwicklung. Die Morphologie und zelluläre Heterogenität von Organoiden brauchen – und können – dann nicht moduliert werden.
Liebau ist nach wie vor fasziniert: „Wir schaffen im Labor nur die Bedingungen, damit sich die Biologie selbst organisieren kann. Es überrascht uns immer wieder, wie sehr wir uns auf die Natur verlassen können. Sobald eine 3D-Struktur entsteht, ist sie dem echten Organ verblüffend ähnlich.“
Zur deren Wachstumsgeschwindigkeit erläutert Liebau: „Maus-Organoide gehen ruckzuck in zwanzig Tagen. Die Reifung menschlicher Organoide dauert dagegen Monate – einfach, weil auch sie die Embryogenese nachempfinden und physiologische Differenzierungsprozesse entsprechend lange dauern. Meist experimentieren wir mit hundert bis dreihundert Tage alten Organoiden, unsere ältesten sind über zwei Jahre alt. Dank unserer mittlerweile intensiven Erfahrungen in ihrer Herstellung generieren wir davon Tausende pro Jahr.“
Wie das im Labor funktioniert, erklärt André Koch, Laborleiter für Translationale Onkologie am Forschungsinstitut für Frauengesundheit der Eberhard Karls Universität Tübingen, detailliert im Werkstattreport auf Seite 38 Link).
Selbstorganisation erleichtert zwar das Leben von Organoid-Forschern, stößt in vitro aber doch an Grenzen. Liebau weiß: „Trotz regelmäßiger Teilungen entwickeln die meisten Organoide einen nekrotischen Kern und bleiben in ihrer Entwicklung stehen. Unsere Photorezeptoren auf der Organoid-Oberfläche beispielsweise reifen zwar auch nach einem Jahr weiter nach, die interne Struktur wird mit der Zeit aber schlechter.“ Denn Diffusion allein kann die metabolischen Anforderungen an Nährstoff- und Sauerstoffversorgung sowie Abfallentsorgung im Zentrum eines Organoids nicht gewährleisten. Das begrenzt Organoide auf Durchmesser von drei bis vier Millimetern.
Um eine Nekrose zu verzögern, existieren inzwischen eine Reihe von Ideen. So kann der Organoid-Durchmesser beschränkt werden – beispielsweise durch Kultivierung an einer Luft-Flüssigkeit-Grenzfläche, mit Vibratomen oder durch künstliche Chips, die Wachstum physikalisch nur in zwei Raumrichtungen zulassen. Nichts davon löst freilich das eigentliche Perfusionsproblem.
Knackpunkt Blutgefäße
Deshalb gelten vaskuläre Netzwerke als der heilige Gral der Organoid-Forschung. Ihre methodische Herausforderung erläutert Liebau: „Selbst bei Zugabe von endothelialen Stammzellen durchziehen sich Organoide nicht automatisch mit Blutgefäßen. Denn die Nährmedien für Gefäßwachstum und Organoidwachstum sind unterschiedlich. Die In-vitro-Selbstorganisation versagt hier. In der Embryogenese ist etwa die Retina auch nicht direkt vaskularisiert, Blutgefäße wachsen erst später ein. Diese Interaktion zweier Entitäten in vitro nachzubilden und dabei die Biologie zu überlisten, ist schwierig.“
Einen Lösungsansatz bieten bestimmte 3D-Biodrucker, sogenannte Inverse Extrusions-Printer. In dicht gepackte Zellhaufen drucken sie Netzwerke von 0,4 bis 1 Millimeter weiten Gelatine-Kanälchen, die im Anschluss liquifiziert, mit Endothelzellen ausgekleidet und mit oxygeniertem Medium geflutet werden. In Laborjournal 3/2020 (S. 66-7) (Link)erklärt Nils Beßler aus der Arbeitsgruppe von Anne Rios am Utrechter Princess Máxima Center für Kinderonkologie, wie ein entsprechender Open-Source-Biodrucker leicht aufgebaut werden kann.
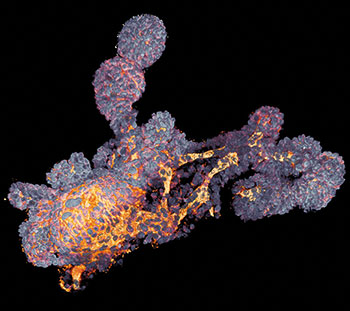
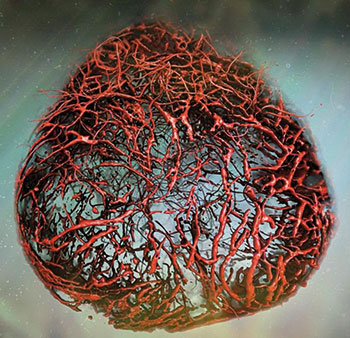
Einen Lösungsansatz auf Seiten der 3D-Zellkultur veröffentlichte im letzten Jahr die Gruppe von Josef Penninger, wie Jürgen Knoblich ansässig am Institut für Molekulare Biotechnologie in Wien. Aus humanen iPS-Zellen züchteten sie vaskuläre Organoide, deren Endothelzellen und Perizyten ein Kapillarnetz formten. Nach Transplantation in Mäuse vernetzten sich die Kapillaren sogar mit dem murinen Blutkreislauf und bildeten perfundierte Arterien, Arteriolen und Venolen aus (Nature 565: 505-10). Wie die Blutgefäß-Organoide von Penninger et al. aktuell dabei helfen, Therapien für COVID-19 zu finden, beschreibt der Infokasten auf S. 36.
Auch wenn das Versorgungshindernis auf dem Weg zu lebensechten Organen also überwindbar scheint, erfordern Blutgefäße, die mit anderen Gewebetypen vereint in einem Organoid heranwachsen, wohl noch einige Jahre intensiver Forschung. Vor allem ist technisch ungeklärt, wie das zur Nährstoff- und Sauerstoffversorgung notwendige Blutdruckgefälle umgesetzt werden kann.
Indes stellen Organ-on-a-Chip-Systeme solcherart funktionelle Gefäßsysteme bereits nach (siehe Infokasten unten). Doch ist das nicht ihr einziger Vorteil, wie Liebaus Kooperationspartner Peter Loskill vom Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik in Stuttgart erörtert:
„Durch Kombination von Organoiden und Organ-on-a-Chip-Systemen verknüpfen wir komplexe Selbstorganisation mit einer kontrollierten technischen Umgebung. Das erlaubt es uns, mehr Kontrolle über die Ausrichtung von Zellen auszuüben. Beispielsweise entsteht das retinale Pigmentepithel während der Organoid-Entwicklung nicht in seiner physiologischen Konfiguration. Anstelle einer äußeren, lagenförmigen Anordnung konzentriert es sich als Zellhaufen an einer bestimmten Stelle des Organoids. Wir müssen also einem Umweg folgen, um das ansonsten zellphysiologisch korrekte Retina-Organoid mit einem schichtförmigen Pigmentepithel zu versehen.“
Nur mit Fingerspitzengefühl
Was die Entwicklungsbiologie in vitro also nicht leistet, ergänzen technische Hilfsmittel. „Dazu differenzieren wir Pigmentepithel-Zellen getrennt von den Organoiden, bringen sie als Monoschicht in eine mikrofluidische Plattform ein, geben nach 24 Stunden Retina-Organoide hinzu und lassen die Photorezeptoren der Organoide erst jetzt kontrolliert ins Pigmentepithel einwachsen.“
Was einfach klingt, verlangt Fingerspitzengefühl. „Um zu verhindern, dass Organoid-Zellen und Pigmentepithel unkontrolliert zusammenwachsen, separieren wir beide Seiten mit einem dünnen Hyaluronsäure-Film. Diese Hydrogel-Barriere funktioniert aber nur, wenn sie die native Physiologie nachspielt. Denn nur eine Stärke von zehn Mikrometern unterbindet den direkten Kontakt zwischen beiden Seiten, ist aber gleichzeitig dünn genug, um die Photorezeptoren im Organoid ausreichend zu stimulieren, durch das Hydrogel hindurchzuwachsen.“
Vorteilhafte Chips
Wie ihr Retina-on-a-Chip-System auf Lichtimpulse reagiert, publizierte das interdisziplinäre Team aus Liebaus Molekularbiologen und Loskills Bioingenieuren bereits im letzten Jahr (eLife 8: e46188). Ansonsten entwickelt Loskills Team weitere Organ-on-a-Chip-Systeme für Bauchspeicheldrüse, Herzgewebe, weißes und braunes Fettgewebe sowie Cervix- und Mammakarzinome.
Als dritten Vorteil gegenüber konventionellen Organoiden sollten Organ-on-a-Chip-Systeme eher Voraussagen darüber ermöglichen, wie ein Organismus als Ganzes auf Medikamente reagiert. Jedes Gewebe innerhalb mehrerer Mikrofluidik-Kammern im Chip repräsentiert dazu ein spezifisches Organ. Wer also wissen möchte, wie sich beispielsweise eine krankhafte Leber auf die Physiologie des Auges auswirkt, braucht nur zwei Kammern mit dem jeweiligen Gewebe zu füllen. Die Mikrokanälchen im Chip erlauben es dann, über das Blutgefäßsystem vermittelte Kreuz-Interaktionen zu quantifizieren.
Der künstliche Blutkreislauf spiegelt vielleicht am besten das Potenzial von Organ-on-a-Chip-Systemen wider. Denn in Zukunft überwinden sie damit noch eine weitere Limitierung klassischer Organoide, nämlich die Integration von Immunkomponenten. Ohne das körpereigene Abwehrsystem zu betrachten, werden Krankheitsverläufe, die Gewebewirkung von Pharmazeutika und medikamentöse Nebenwirkungen im Gesamtorganismus nie vorhersagbar sein. In die Mikrokanälchen von Organ-on-a-chip-Systemen können immerhin nach Wahl spezifische Immunzellen injiziert werden.
Entsprechend fassen Stefan Liebau und Peter Loskill ihre interdisziplinäre Zukunftsvision zusammen: „Wir passen Organoide und Organ-on-a-Chip-Systeme so an die Natur an, dass wir die physiologischen Signalwege zwischen Zelltypen nachspielen, pharmakologische Studien erleichtern und vielleicht den einen oder anderen Tierversuch ersetzen können. Auf diese Weise könnten die neuartigen Modelle sowohl Grundlagen- wie auch angewandte Forschung revolutionieren.“
Infokasten: Definitionen
Organoide
... sind multizelluläre 3D-Zellkultur-Aggregate, die Krankheitsbilder oder künstliche Miniaturvarianten von Organen repräsentieren. Sie entstehen durch Zugabe spezifischer Wachstumsfaktoren zu embryonalen Stammzellen aus Blastozysten oder zu adulten und induzierten pluripotenten Stammzellen (iPS-Zellen) aus Gewebebiopsien. Forscher nutzen hierbei die Eigenschaft von Stammzellen, durch Selbstorganisation Organ-spezifisches und funktional ausgereiftes Gewebe zu formen – oft innerhalb einer Trägermatrix aus Interzellularsubstanzen. Im Gegensatz zu Sphäroiden spiegelt das 3D-Mosaik ihrer Zellen die zelluläre Heterogenität, die In-vivo-Morphologie und die Funktionalität menschlicher Organe in vitro wider.
Adulte und iPS-Zellen bieten den zusätzlichen Vorteil, humane Organoide direkt aus Proben gesunder oder kranker Personen mit deren individuellen Genomen induzieren zu können. Welche Stammzellen über welche Signalkaskaden der Keimblattbildung und Organanlage wie differenziert werden können, ist Gegenstand aktiver Forschung.
Mina J. Bissell am kalifornischen Lawrence Berkeley National Laboratory bereitete der 3D-Zellkultur über 25 Jahre den Weg. Eine bahnbrechende Studie aus dem Labor von Hans Clevers am Utrechter Hubrecht-Institut für Entwicklungsbiologie und Stammzellforschung schuf die konzeptionellen Grundlagen moderner Organoid-Forschung (Nature 459: 262–5).
Sphäroide
... sind meist kugelförmige 3D-Zellkulturen aus einer oder mehreren Zellarten in oftmals homogener Mischung, die räumlich nicht wie das entsprechende Gewebe in vivo organisiert sind. Sie verfügen nur über begrenztes Potenzial zur Selbstorganisation, können im richtigen Zellkulturmedium aber häufig zu Organoiden reifen.
Organ-on-a-chip-Systeme
... sind mikrofluidische Zellkultur-Biochips, in denen durch die Kombination von Interzellularsubstanzen, mechanischen Komponenten sowie der Interaktion verschiedener Zelltypen physiologische Mikroumgebungen geschaffen werden. Meist werden sie aus dem Silicium-Polymer Polydimethylsiloxan (PDMS) hergestellt. Sie enthalten Mikrokanälchen, durch die kontrolliert Zellkulturmedium fließt, wodurch ein konstanter Austausch von Sauerstoff, Nährstoffen und Metaboliten sichergestellt wird.
Das erste biomimetische Mikrosystem, das die Funktionalität eines menschlichen Organs nachbildete, entstammte dem Labor von Donald E. Ingber am Wyss Institute for Biologically Inspired Engineering der Harvard University Boston (Science 328: 1662-8).
Infokasten: Organoide im Corona-Einsatz
Ihrer Reputation als In-vitro-/-In-vivo–Grenzmodelle machen vaskuläre und renale Organoide im Labor von Josef Penninger am Wiener Institut für Molekulare Biotechnologie gegenwärtig alle Ehre.
Im Jahr 2005 identifizierten die Wiener in Mäusen das Transmembranprotein Angiotensin-konvertierendes Enzym 2 (ACE2) als den Rezeptor der SARS-CoV-Spike-Proteine. Mit humanem rekombinantem (hr) ACE2 schützten sie Mäuse vor SARS und prophezeiten “a possible therapy for a syndrome affecting millions of people worldwide” (Nature 436:112-6). Im März 2020 identifizierten Cryo-EM-Studien ACE2 auch als den menschlichen SARS-CoV-2-Rezeptor.
Neben dem Atemwegsepithel und dem Lungenparenchym exprimieren auch Herz, Magen-Darm-Trakt, Niere sowie Blut- und Lymphendothel ACE2. Das Multiorganversagen in schweren COVID‑19-Fällen ließe sich folglich anhand einer Verbreitung des RNA-Virus durch den Blutkreislauf erklären. Virale RNA findet sich aber nur im Blut von einem Prozent aller COVID-19-Patienten (JAMA 2020, doi: 10.1001/jama.2020.3786).
Penninger und sein Team infizierten deshalb humane Blutgefäß-Organoide mit SARS-CoV-2 und wiesen steigende virale RNA-Titer mittels quantitativer RT-PCR innerhalb der nächsten sechs Tage nach. SARS-CoV-2 kann Blutgefäßzellen also direkt infizieren. Zeitgleich demonstrierten sie, dass SARS-CoV-2 auch humane Nieren-Organoide infizieren und sich in ihnen vermehren kann.
Wenn sie beide Organmodelle jedoch mit einem Mix aus SARS-CoV-2 und hrACE2 infizierten, verringerten sich Infektionsraten und Virenlast abhängig von der hrACE2-Dosis (Cell 2020, doi: 10.1016/j.cell.2020.04.004). Eine hrACE2-Therapie könnte also nicht nur die Ausbreitung von Viren blockieren, sondern die Lunge und andere Organe auch vor Schäden schützen.
Das hofft zumindest das von Penninger mitgegründete Wiener Biotech-Unternehmen Apeiron Biologics AG – und bereitet gerade eine klinische Phase-2-Studie einer intravenösen Infusion von hrACE2 in COVID-19-Patienten vor. Da sich hrACE2 zwischen 2009 und 2017 bereits in klinischen Phase-1- und -2-Prüfungen gegen akutes Lungenversagen bewiesen hat, stehen die Chancen gar nicht schlecht.
Last Changed: 08.05.2020