Special Mechanobiologie und Zellphysik
Die neue Dimension
Interview: Juliet Merz, Laborjournal 11/2017
Erst pieken, dann ziehen – Viola Vogel von der ETH Zürich mutet ihren Zellen viel zu. Im Interview erklärt sie, warum sie das tut und weshalb die lange ignorierte Mechanobiologie für die Zukunft so wichtig ist.
Laborjournal: Frau Vogel, unser Special dreht sich um Mechanobiologie. Was ist das eigentlich?
Viola Vogel » Die Mechanobiologie ist ein ganz neues Gebiet, was eigentlich erst durch den Zugang zu vielen Nanotechnologien ermöglicht wurde. Mit ihnen können wir messen, mit welchen Kräften Zellen an ihrer Umgebung ziehen oder Moleküle gestreckt werden. Denn das Zellverhalten wird nicht nur genetisch und biochemisch reguliert, sondern auch mechanisch.
Und die Mechanobiologie versucht herauszubekommen, wie?
Vogel » Genau. Wie mechanische Kräfte zusammen mit den genetischen Komponenten und biochemischen Faktoren Zellfunktionen regulieren.
Sie hatten gerade erwähnt, dass die Mechanobiologie noch jung sei. Seit wann gibt es sie denn?
Vogel » Vor mehreren Jahrzehnten gab es bereits die Biomechanik, die sich beispielsweise mit Knochen und Knochenbrüchen auseinander gesetzt hat. Die Mechanobiologie hingegen ist um die zwanzig Jahre alt und versucht Zusammenhänge zu analysieren, die man allerdings erst einmal messen können muss. Es ist nicht ganz klar, wer den Begriff zu allererst geprägt hat. Aber das Gebiet als solches ist sehr jung, wächst jedoch seit den letzten zehn Jahren exponentiell.
Mit welchen Methoden arbeiten Mechanobiologen?
Vogel » Man muss sich rückbesinnen, dass mindestens 99 Prozent der Biologie in Petrischalen gelernt wurde. Biologen besiedeln die Oberfläche also mit Zellen und ziehen daraus irgendwelche Rückschlüsse. In natürlichem Gewebe hingegen ist eine Zelle Kräften ausgesetzt: Das können Zugspannungen, Drücke oder mechanische Beanspruchungen durch Flüssigkeiten sein, wie wir sie aus dem kardiovaskulären System kennen. Alle diese Faktoren haben Biologen in ihren Analyse-Techniken lange nicht miteinbezogen. Die großen Fortschritte erzielten die Forscher, indem sie Zellen nicht mehr nur in eine Petrischale setzten, sondern zum Beispiel in mikro- oder nanofabrizierte Umgebungen sowie in Microfluidic Devices.
Welcher Vorteil ergibt sich daraus?
Vogel » Dadurch können wir speziell den Einfluss von Materialeigenschaften wie Steifigkeit oder Topographien auf das Zellverhalten anschauen und beispielsweise Flussgeschwindigkeiten sehr genau kontrollieren. Wir können mit Optical und Magnetic Tweezers an Zellen ziehen, sie stimulieren oder anstupsen. Alle diese Techniken hatten wir früher nicht zur Verfügung. Und auch die optische Mikroskopie hat rasante Fortschritte gemacht. So können wir heute auf der Submikron- und Nano-Skala Moleküle in Zellen sehen, abbilden und funktionell verstehen.
Mit welchen Geräten arbeiten Sie im Labor?
Vogel » Von Steered Molecular Dynamics Simulations, Atomic Force Microscopes und Elektronenmikroskopen bis hin zu hochaufgelöster optischer Mikroskopie ist nahezu alles dabei. Einige dieser Technologien haben wir bei uns im Labor; andere stehen in den User Facilities zur Verfügung.
Und was stellen Sie damit an?
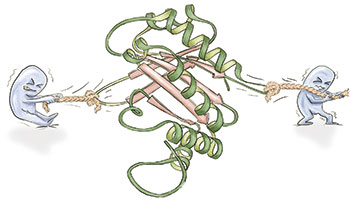
Vogel » Wir versuchen seit zwanzig Jahren zu verstehen, auf welche Weise Proteine ihre Funktion verändern, wenn wir sie strecken. In der Biochemie wurde lange angenommen, dass jedes Protein eine Struktur-Funktions-Beziehung hat. Streckt man allerdings ein Protein, ändert es seine Struktur und damit auch seine Funktion. Wir beschäftigen uns damit, wie sich die Struktur ändert, wenn wir an Proteinen ziehen, und welche neuen Funktionszustände wir mechanisch einstellen können
Wenn Sie die Proteine strecken, bleiben diese in dieser Konformation oder falten sie sich wieder zurück?
Vogel » Es gibt sicherlich ein paar Proteine, die nicht wieder in ihren Originalzustand zurückkehren können. Aber die meisten falten sich sehr schnell wieder zurück – vor allem diejenigen Proteine, die von den Organismen als mechanisch-chemische Schalter benutzt werden. Die sind in aller Regel sehr robust, denn man möchte natürlich einen solchen Schalter nicht beim ersten Strecken zerstören. Das heißt, sie haben besonders gut ausgeprägte Kinetiken um die originale Sekundärstruktur wieder neu zu bilden.
Kommen diese Streckungsprozesse der Proteine in der Natur wirklich so vor?
Vogel » Das war natürlich die ganz große Frage, weshalb es auch so lange gedauert hat, bis die Mechanobiologie in weiten Kreisen akzeptiert wurde. Es ist leichter, mit einem Atomic Force Microcope Proteine im Labor zu strecken als das in der Zellkultur bei extra- und intrazellulären Proteinen zu zeigen. Das war ein steiniger Weg. Biologen und Biochemiker haben gelernt, in Gleichgewichtsstrukturen von Proteinen zu denken. Es hat daher sehr viele sehr gute Experimente gebraucht, da dieses Denken die Proteinforschung lange völlig dominiert hat.
Und was ist aktuell der Stand der Dinge?
Vogel » Dass die Zellen sehr gut Proteine strecken können und dass dies eine wesentliche Rolle im Cell Signalling sowie in der Art und Weise spielt, wie Zellen auf ihre physikalische Umgebung reagieren. Zellen müssen physikalische Stimuli wahrnehmen. Wir merken das zum Beispiel, wenn wir zwei Tage unsere Beine nicht bewegen: Das Muskelgewebe baut schnell ab. Das zeigt, wie sehr die Zellen von einer mechanischen Stimulation abhängig sind. Aber auch, dass sie die physikalischen Stimuli ihrer Umgebung wahrnehmen.
Könnten Sie ein konkretes Beispiel nennen?
Vogel » Dass Zellkräfte groß genug sind, um Proteine zu strecken, haben wir zu allererst an dem extrazellulären Protein Fibronektin demonstrieren können (PNAS 98: 14464-8; PNAS 99: 5139-43). Denn die extrazelluläre Matrix gibt den Zellen nicht nur ein Zuhause, sondern interagiert intensiv mit ihnen, teilweise über die Fibronektin-Fasern.
Wir haben nun festgestellt, wie der Spannungszustand der Fasern von den Zellen und sogar von Bakterien wahrgenommen wird, und welche funktionellen Konsequenzen das hat.
Und welche funktionelle Konsequenzen hat das?
Vogel » Das Bakterium Staphylococcus aureus hat ein Peptid entwickelt, mit dem es sich an Fibronektin festhalten kann. Dass sich Bakterien an den Proteinen festhalten können, war bekannt, aber wir haben festgestellt, dass das bakterielle Peptid ein Mechanosensor ist. Dieser kann sich nur an relaxierte, also nicht gestreckte Fasern anbinden. Solche Fasern kommen beispielsweise in Wunden vor, wo sie entweder mechanisch oder enzymatisch geschnitten wurden. Das hat uns völlig begeistert.
Warum?
Vogel » Es zeigt, dass Bakterien einen Sensor entwickelt haben, der es ihnen ermöglicht, über Wunden in ihren Wirt einzudringen. Das Ganze an einer Wunde zu zeigen, ist allerdings extrem schwer, denn eine bakterielle Oberfläche enthält extrem viele molekulare Bausteine. Außerdem sind Wunden unendlich kompliziert, sodass wir diesen Nachweis mit aufgereinigten Peptiden und Fibronektin-Fasern zeigen mussten.
Planen Sie, in Zukunft auch mit Wunden zu arbeiten?
Vogel » Im Prinzip versuchen wir primär neue molekulare Mechanismen zu entdecken. In der Wunde gibt es so unendlich viele Moleküle, die alle miteinander interagieren oder konkurrieren – da ist ein eindeutiger Nachweis sehr schwer. Selbst wenn wir glauben, einen Nachweis in der Wunde erbracht zu haben, wäre es fast unmöglich zu zeigen, dass das Verhalten nicht durch etwas anderes beeinflusst wurde.
Geben Sie uns doch noch einen weiteren Einblick in Ihr Labor.
Vogel » Wir versuchen auch herauszubekommen, wie eine Zelle ihr Cytoskelett umbaut, um gegen ihre Umgebung Spannung zu erzeugen.
Warum macht eine Zelle so etwas?
Vogel » Damit kann sie beispielsweise die Weichheit oder Topographie eines Materials erkennen. Das wirkt sich im Umkehrschluss auf ihre nuklearen Zellfunktionen aus.
Inwiefern könnte man dieses Wissen einsetzen?
Vogel » Es wurde in der Community schon gezeigt, dass Stammzellen sich anders differenzieren, wenn sie sich auf einer harten oder wechen Oberfläche befinden. Außerdem migrieren Zellen unterschiedlich schnell, abhängig von der physikalischen Eigenschaft der Unterlage. Oder Tumore werden bösartiger, je rigider das umliegende Gewebe ist. Es gibt also unheimlich viele Hinweise, dass die physikalischen Eigenschaften einer Umgebung teilweise sogar biochemische Stimuli überschreiben können. Aber wie genau die Zelle das wahrnimmt, und sich eine Veränderung der Genexpression einstellt – da gibt es noch viele offene Fragen. Deshalb ist es auch so ein schönes, tolles Gebiet.
Was fasziniert Sie daran am meisten?
Vogel » In vielerlei Hinsicht ist es bemerkenswert, dass sich aus einer Eizelle ein komplexer Organismus entwickeln kann. Diese Komplexität haben wir aber nie von Grund auf nachbauen können. Wenn Zellen keine mechanischen Kräfte ausüben könnten, würde sich kein Organismus bilden. Denn wenn man die molekularen Motoren inhibiert, mit denen Zugkräfte aufgebaut werden, dann stoppt die Embryonalentwicklung. Der Aufbau von Kräften ist also absolut fundamental für unser Leben.
Und kann vermutlich auch großen Schaden anrichten?
Vogel » Nehmen wir als Beispiel den Bluthochdruck. Dieser führt zu unglaublich vielen Funktionsveränderungen in einer Vielzahl von Organen und Geweben. Eine andere Auswirkung einer mechanischen Dysbalance ist beispielsweise die Osteoporose.
Um die Komplexität der Auswirkung von Kräften auf Zellen zu verstehen, braucht es sicherlich ein hochqualifiziertes Team.
Vogel » Nun, die Dimension Mechanik wurde lange Zeit außer Acht gelassen. Allmählich beginnen Physiker und Ingenieure, ihr Wissen und ihre Werkzeuge zur Biologie beizutragen. Die Herausforderung für Biologen ist, dass sie diese Werzeuge und ihre Quantifizierung beherrschen. Während umgekehrt die Physiker und Ingenieure lernen müssen, die biologischen Assays anzuwenden. Es sind wirklich noch zwei Welten, die fusionieren müssen, um große Durchbrüche zu ermöglichen.
Sie leiten ein interdisziplinäres Team. Gibt es da manchmal Schwierigkeiten?
Vogel » Das ist eine Frage der Perspektive. In der Physik bin ich so aufgewachsen, dass jeder Student die gleichen Grundvorlesungen hatte – selbst der Chef. Deshalb hat jeder versucht, ein Thema zu bekommen, was sich von dem des Kollegen fundamental unterschied. Bei uns ist es umgekehrt: Wir versuchen uns große Themen vorzunehmen. Jeder kann mit seinem individuellen Hintergrund etwas Besonderes dazu beitragen oder anderen helfen. Trotz unterschiedlicher Fähigkeiten sehen die Leute einen Mehrwert darin, wenn sie zusammenarbeiten. Deshalb ist es gerade bei interdisziplinären Fragestellungen wichtig, ein interdisziplinäres Team innerhalb der Arbeitsgruppe zu haben. Am spannendsten ist es, wenn im Seminar ein Problem angesprochen wird, denn irgendjemand sagt immer: „Die Technik habe ich früher einmal gelernt, ich mache das Experiment gerne.“ Auf die Art und Weise ist es sehr belebend und stimulierend. Es ist wundeschön, ein interdisziplinäres Team führen zu dürfen.
Ist es manchmal nicht schwierig, die gleiche „Sprache“ zu sprechen?
Vogel » Durch die interdisziplinären Studiengänge gibt es im Moment in der Ausbildung riesige Veränderungen. Allein die Kommunikation unter Studenten wird durch spezielle interdisziplinäre Masterkurse immer leichter. Das war vor zwanzig Jahren sicherlich schwieriger. In Bewerbungsgesprächen merke ich immer wieder, dass die Leute ein interdisziplinäres Team suchen. Sie sind dann sehr gewillt, allerdings braucht man immer wieder Geduld, ihnen zu erklären, warum man etwas machen möchte und wie man dies erreichen könnte.
Dann ist Vertrauen auch ein großer Faktor?
Vogel » Ja, auf alle Fälle.
Wie geht es bei Ihnen im Labor weiter?
Vogel » Wir möchten gerne wissen, unter welchen Umständen die Prinzipien, die man auf der zellulären Ebene erkannt hat, in Geweben von Bedeutung sind. Leider gibt es bisher keine Möglichkeit, in Geweben die Kräfte zu messen, mit denen Zellen an ihren Gewebefasern ziehen. Und da entwickeln wir gerade die bakteriellen Peptide als ganz neue Proben, um so etwas zu ermöglichen.
Können sie diesbezüglich noch genauer ins Detail gehen?
Vogel » Das ist ein bisschen schwierig, weil ich noch unter Embargo stehe. Die Zielsetzung der Technik ist es, dass wir in Geweben Regionen identifizieren können, wo die Zellen sehr stark oder schwach an ihrer Umgebung ziehen – wie auch, dass wir Korrelationen zwischen gestreckten und relaxierten Fasern sowie erkranktem Gewebe herstellen können. Unsere Vision ist es, letztlich zu verstehen, welchen funktionellen Einfluss das Strecken von Gewebefasern auf die Organfunktionen hat.
Wo sehen Sie die Mechanobiologie in ein paar Jahren?
Vogel » Im Moment gibt es zwei große Wellen in der Biologie: die Systembiologie und Personalized Health. Beide Gebiete ignorieren noch bis heute die Tatsache, dass Kräfte Funktionen steuern können. Eigentlich sind das aber wichtige Aspekte, die berücksichtigt werden müssen, um vernünftige Rückschlüsse ziehen zu können.
Denken Sie, das wird sich bald ändern?
Vogel » Immer mehr Veröffentlichungen zeigen, dass Funktionen durch Kräfte geschaltet werden, sodass die Forschung dieses Gebiet in der Zukunft nicht mehr ignorieren kann. Die Schwierigkeit der Mechanobiologie ist, dass die meisten Assays keine High-Throughput-Assays sind. Deshalb werden auch alle Medikamente bislang nur gegen Proteine im Gleichgewichtszustand gescreent. Selbst Signalling-Diagramme zeigen stets, welche Proteine miteinander agieren, aber nicht, ob solch eine Interaktion durch Kräfte modifiziert werden kann.
Wenn sie an Signalling-Diagramme denken, steht ganz selten dabei, dass eine Interaktion mechanisch reguliert wird. Und daran merkt man, wie viel noch vor uns liegt, um bei all diesen Interaktionen herauszufinden, ob sie mechanisch schaltbar sind oder nicht – und ob das funktionelle Konsequenzen hat.
Könnte man dieses Wissen dann für Medikamente einsetzen?
Vogel » Ich nehme stark an, dass das zukünftig der Fall sein wird. Überdies sollten wir langfristig darüber nachdenken, ob die gegenwärtigen High-Throughput-Screening-Plattformen angemessen sind. Oder ob viele Funktionen, die man medikamentös regulieren sollte, übersehen werden, weil man dafür kein gutes Screening hat. Das ist das Dilemma zwischen High-Throughput und Low-Throughput, das die meisten biomechanischen Assays heute leider immer noch haben.
Zur Person
Die gebürtige Tübingerin Viola Vogel studierte Physik sowie Biologie an der Johann-Wolfgang-Goethe-Universität Frankfurt am Main und promovierte am Max-Planck-Institut für Biophysikalische Chemie in Göttingen. Es folgte eine zweijährige Postdoktorandenzeit an der University of California in Berkeley. Im Jahr 1991 begann Vogel ihre akademische Laufbahn als Assistant, Associate und Full Professor für Bioingenieurswesen an der University of Washington in Seattle. Sechs Jahre später gründete sie dort das Zentrum für Nanotechnologie. 2004 kehrte Vogel aus den USA in den deutschsprachigen Raum zurück und leitete in den Materialwissenschaften der ETH Zürich das Labor für biologisch orientierte Materialien. Seit der Gründung des neuen ETH-Departments für Gesundheitswissenschaften und Technologien im Jahr 2012 ist Vogel Leiterin des Labors für Angewandte Mechanobiologie.
Last Changed: 02.07.2018