Mini-Zellhäcksler
Produktübersicht: Zellaufschluss-Geräte
Zellaufschluss-Geräte 
Noch dominieren Homogenisierer und Kugelmühlen den Markt für Zellaufschlussgeräte. In den Entwicklungslaboren wartet aber bereits die nächste Zellschredder-Generation auf die Kommerzialisierung. Statt Pistill und Glaskugeln nutzt sie mikrofluidische Chips, um die Zellen in Stücke zu reißen.
Wenn das letzte Stündlein ihrer Zellkulturen geschlagen hat, kennen Biowissenschaftler keine Gnade: Mit brachialer Gewalt machen sie dem Leben der liebevoll hochgepäppelten Zellen ein Ende. Je nach Zelltyp zerquetschen sie die Zellen wahlweise im Homogenisator, durchlöchern sie in der Kugelmühle mit Glaskugeln, zerreißen sie in der French Press mit tödlichen Scherkräften oder zerfetzen sie in den implodierenden Luftblasen von Ultraschall-Geräten.
Noch rabiater gehen Pflanzenforscher zu Werke, um die besonders stabilen Bollwerke von Pflanzenzellwänden zu knacken. Hier hilft in vielen Fällen nur ein kurzes Bad in flüssigem Stickstoff und das Zerstoßen der mürbe gemachten Zellen mit Pistill und Mörser. Reicht selbst das nicht aus, kapitulieren die Zellen spätestens nach einigen herzhaften Schlägen mit einem Holzhammer auf den Cellcrusher – einen speziell geformten Pistill aus Edelstahl, der exakt in einen dazu gehörenden Edelstahl-Mörser passt. Für die ganz harten Kandidaten, wie zum Beispiel Samen, gibt es für den Cellcrusher-Mörser auch noch einen passenden Bohreinsatz. Bei entsprechender Drehzahl und ausreichendem Druck zermalmt dieser sogenannte Drill-Bit auch die widerstandsfähigsten Zellen zwischen der Wandung des Mörsers.
Neben diesen klassischen Geräten für den physikalischen Zellaufschluss, die in der Produktübersicht von Laborjounal 5/2013 auf Seite 42 näher erläutert wurden, finden sich zunehmend auch miniaturisierte, auf Mikrofluidik- oder Lab-on-a-Chip-Verfahren basierende Systeme. Die Chips bestehen zumeist aus dem farblosen, inerten Kunststoff Polydimethylsiloxan (PDMS), in den winzige Mikrokanäle eingearbeitet werden. Die in einer Pufferlösung suspendierten Zellen treten zumeist über ein regelbares Miniventil in das Kanalsystem ein, werden in diesem zunächst vereinzelt und gelangen schließlich aufgereiht wie an einer Perlenschnur zur eigentlichen Aufschlusszone. Was sie hier erwartet, hängt von der Aufschlusstechnik ab, die sich die Chip-Designer für die Zellen ausgedacht haben.
French Press im Miniformat
So basiert der Aufschluss beim sogenannten Microfluidizer der US-Firma Microfluidics wie bei der French Press auf Scherkräften, die die Zellen auseinanderreißen. Bei der French Press treten diese auf, wenn die Zellsuspension mithilfe eines hydraulisch angetriebenen Zylinders einem sehr hohen Druck ausgesetzt und anschließend durch ein Auslassventil in ein Auffanggefäß dispensiert wird. Auf dem kurzen Weg durch das Ventil sinkt der auf die Zellwand einwirkende Druck schlagartig von knapp 3.000 Bar auf Atmosphärendruck. Durch die hierbei auftretenden Scherkräfte platzen die Zellen und entlassen ihren Inhalt in das Auffang-Tube.
Im Microfluidizer wird die Zellsuspension ebenfalls mit hohem Druck von bis zu 1.500 Bar in die Aufschlusseinheit gepresst. Diese besteht aus einem etwas weiteren Kanal, dessen Ypsilon-förmig aufgespaltene Enden über ein sehr dünnes Zwischenstück miteinander verbunden sind. In der Mitte des Verbindungskanals befindet sich ein kleines Auslassventil.
Man kann sich leicht ausmalen, was passiert, wenn die Zellen mit einem Affenzahn von 400 Metern pro Sekunde an den Enden des Ypsilons ankommen und mit hohem Druck in den wesentlich dünneren Verbindungskanal gezwungen werden. Schon in dieser sogenannten Scherzone reißen die auftretenden Kräfte die meisten Zellen in Stücke. Der Rest wird spätestens bei der Passage der High-Impact-Zone im Auslassventil zerfetzt, wenn der Druck plötzlich abfällt.
Eine völlig andere mikrofluidische Aufschlusstechnik dachte sich ein Team von der Tsinghua University in Peking aus (Biomicrofluidics 11: 024112). Der Mikrofluidik-Kanal der Chinesen ist in eine kleine Plexiglasplatte eingeritzt und wird von einer dünnen Membran aus PDMS abgedeckt. Der Verlauf des Kanals ist ziemlich unspektakulär, erfüllt seinen Zweck jedoch perfekt: Ein kurzer, über ein Mikroventil gesteuerter Einlasskanal mündet in einen haarnadelförmigen Kreisbogen, der schließlich in einen parallel zum Einlasskanal verlaufenden, ebenfalls mit einem Ventil versehenen Auslasskanal übergeht.
Ein über dem Zentrum der Haarnadel angebrachter Rotor dreht sich im Kreis und drückt dabei drei symmetrisch angeordnete Stahlkugeln in den mit der PDMS-Folie abgedeckten Kanal. Die rotierenden Kugeln befördern die Zellsuspension wie eine Peristaltik-Pumpe durch das Kanalsystem und zerquetschen gleichzeitig sämtliche Zellen, die in dem Kreisbogen der Haarnadel zwischen Kanalwand und Kugeloberfläche geraten.
Einfach aber wirkungsvoll
Ähnlich raffiniert konstruiert ist auch der Chip japanischer Spezialisten für Nanogeräte um Yoshinobu Baba von der Nagoya University, der für den Aufschluss von Bakterien- oder Hefezellen konzipiert ist (ACS Nano: 13, 2262-73). Auf den ersten Blick sieht der aus einem Silicium-Waver gefertigte Chip ziemlich einfach gestrickt aus: Er enthält nur einen einzigen schnurgeraden Mikrokanal, der mit einer hauchdünnen Folie aus mehrschichtigem Silicium (fused silica) abgedeckt ist. Der Kanal verbindet ein rundes Einlass-Reservoir an einem Ende mit einem ebenfalls kreisförmigen Auslass-Reservoir am anderen Ende.
Das Interessante an dem japanischen Mikrofluidik-Chip ist die Zellaufschluss-Zone, die sich etwa über die halbe Länge des Kanals erstreckt. Babas Mitarbeiter verankerten hier auf dem Kanalboden unzählige, nur zehn Nanometer dicke und wenige Mikrometer lange Nanodrähte aus Zinndioxid, die zusätzlich mit Siliciumdioxid beschichtet sind. Die Drähte ragen senkrecht in die Höhe und bilden ein dichtes Geflecht, das wie ein Mini-Nagelbett aussieht.
Intuitiv würde man vermuten, dass die durch den Mikrokanal geschleusten Zellen von den Spitzen der Drähte aufgeschlitzt werden. Die Nanodrähte sind jedoch nicht stabil genug, um in die Zellen eindringen zu können. Die Zellen werden vielmehr mithilfe eines elektrischen Feldes durch den Drahtverhau hindurchgezogen und verheddern sich schließlich heillos zwischen den abertausenden Drähten. Ihre Zellmembranen werden hierdurch so stark gedehnt und verformt, bis sie letztendlich zerplatzen und den Inhalt freigeben.
Babas Team kombinierte den Nagelbett-Aufschluss mit der isothermalen Amplifikation der freigesetzten DNA. Dazu entnahm es den entstandenen Zellextrakt am Auslass-Reservoir und setzte diesen in einer Loop-Mediated-Isothermal-Amplification-(LAMP)-Reaktion ein.
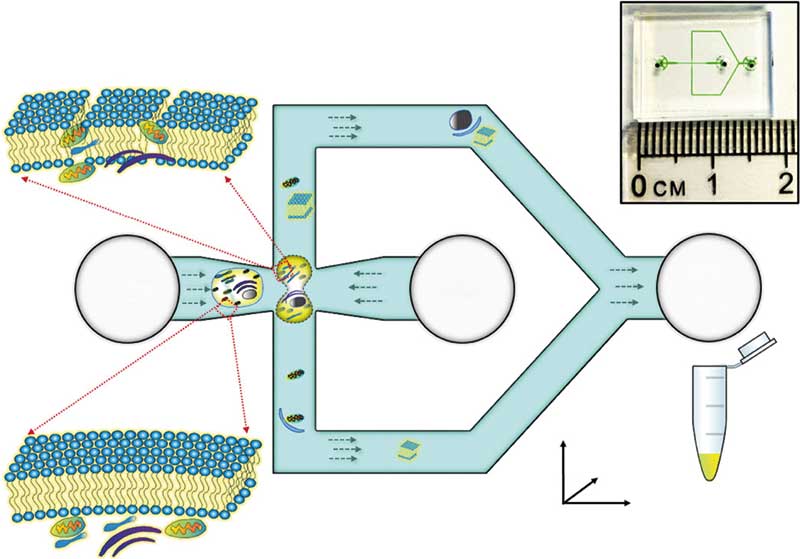
Leider zerlegen die oben genannten Zellaufschluss-Chips auch die Membranen von Zellorganellen. Mit dem entsprechenden Chip-Design lässt sich dies jedoch verhindern: Ein Team von der Chinese University of Hongkong konstruierte einen mikrofluidischen Zellschredder, mit dem man intakte Mitochondrien aus Säugerzellen isolieren kann (Microsyst. Nanoeng.: 4:39). Auch dieser Mikrofluidik-Chip ist erstaunlich simpel aufgebaut und wie üblich aus einer dünnen PDMS-Platte gefertigt, die mit einer PDMS-Folie versiegelt ist. In den Chip ist ein kreuzförmiger Mikrokanal eingearbeitet: Zwei Enden des Kreuzes führen über einen fünfeckigen Kanal zu einem gemeinsamen Auslass, an den beiden offenen Enden befindet sich jeweils ein Einlass (Abbildung oben).
Fein dosierte Scherkraft
Pumpt man in eines der offenen Enden eine Zellsuspension und in das andere eine Pufferlösung, treffen die zwei Flüssigkeits-Ströme am Kreuzungspunkt aufeinander. Je schneller sie fließen, desto stärker sind die hydrodynamischen Scherkräfte, die an der Kreuzung auf die Zellen einwirken. Die Mitochondrien-Membran ist jedoch stabiler als die Zellmembran. Stellt man die Fließgeschwindigkeiten von Puffer und Zellsuspension entsprechend ein, wird daher nur die Zellmembran von den hydrodynamischen Scherkräften zerstört, während die Mitochondrien-Membran intakt bleibt. Und das Beste daran: Die Ausbeute an intakten Mitochondrien ist mit dem Zellschredder um 40 Prozent höher als bei der üblichen Extraktion mit dem Dounce-Homogenisator oder einem Extraktions-Kit.
Noch existiert von dem Mini-Zellschredder nur eine Konzeptstudie – die man aber theoretisch nachbauen kann. Wem das zu aufwendig ist, dem bleiben immer noch die klassischen Zellaufschluss-Geräte auf den nächsten Seiten.
Zellaufschluss-Geräte im Überblick 
(Erstveröffentlichung: H. Zähringer, Laborjournal 09/2019, Stand: August 2019, alle Angaben ohne Gewähr)
Letzte Änderungen: 10.09.2019