Vielseitige Bildermacher
Produktübersicht: Gel-Dokumentations-Systeme-Equipment
Gel-Dokumentations-Systeme im Überblick
(08.04.2021) Aufnahmen von Gel- oder Western-Blot-Banden sind oft entscheidende Beweisstücke für durchgeführte Experimente. Umso wichtiger ist ein Imager, der glasklare, unverfälschte Bilder liefert.
Wenn das Nukleinsäure- oder Proteingel gelaufen ist oder die Proteine auf der WesternBlot-Membran angekommen sind, geht es mit Gel oder Blot zumeist schnurstracks zum Gel-Dokumentations-System, um die Banden auszuwerten und im anlogen oder digitalen Laborbuch festzuhalten. Im einfachsten Fall reicht hierzu eine digitale Version der guten alten GelCam, die bis zum Ende der analogen Fotografie in vielen Laboren eingesetzt wurde. Die ursprüngliche, in die pyramidenförmige Dunkelhaube der GelCam integrierte Sofortbildkamera ersetzten die Hersteller durch eine digitale Kamera, die man an einen PC mit installierter Bildaufnahme-Software anschließen kann. Noch ein passender UV-Beleuchtungstisch alias UV-Transilluminator dazu und fertig ist ein einfaches und günstiges, aber grundsolides Imaging-System für die Dokumentation fluoreszenzgefärbter Nukleinsäuren oder Proteine in Agarose- beziehungsweise Acrylamid-Gelen.
Ergänzt mit einem Weißlicht-Transilluminator oder einer Weißlicht-Konvertierungsplatte, die das UV-Licht des Illuminators in weißes Licht umwandelt, funktionieren die digitalen Erben der GelCam auch mit Protein-Gelen, die mit Coomassie-Brilliant-Blau oder Silber gefärbt sind – und wer Angst hat, dass die UV-Strahlen die aufgetrennte DNA schädigen, kann die Dunkelhaube auch auf einem Blaulicht-Illuminator platzieren, um zum Beispiel mit SYBR-Green gefärbte DNA-Banden aufzunehmen.
Alles an Bord
Wesentlich vielseitiger, schneller und auch um einiges schicker als Hauben-Systeme sind sogenannte Stand-alone-Geräte. Bei diesen sind alle benötigten Komponenten für die Aufnahme und Darstellung von Gelen oder Blots in einem Gehäuse integriert, das bequem auf dem Arbeitstisch Platz findet. Der Transilluminator ist zumeist in einem Schubfach am Boden der Dunkelkammer untergebracht, das über eine kleine Tür oder vertikale Klappe zugänglich ist. Bei besonders komfortablen Modellen fährt die an den Ladeschacht eines überdimensionierten CD-Spielers erinnernde Schublade nach einem kurzen Druck auf einen Touchscreen aus dem Gehäuse heraus. Danach muss man nur noch das Gel oder die Blotmembran auf die Glasplatte des Illuminators auflegen und den gewünschten Bildaufnahme-Modus aus einem Drop-Down-Menü auswählen. Die Aufnahme und Auswertung des Gels erledigt die Software des Imagers nach dem Einziehen des Illuminators in die Dunkelkammer mehr oder weniger von alleine.
Schon die Einsteigermodelle sind mit beinahe allem ausgestattet, was man für die alltägliche Analyse und Dokumentation von Gelen und Blots benötigt, oder können entsprechend nachgerüstet werden. Zur Grundausrüstung gehören in der Regel austauschbare Transilluminatoren für UV-, Weiß- oder blaues LED-Licht, unterschiedliche Konverterplatten, zusätzliche LEDs in der Dunkelkammer für die Epi-Beleuchtung der Gele von oben mit weißem oder blauem Licht – und natürlich eine digitale Kamera, die scharfe und kontrastreiche Bilder liefert.
Die Basis-Geräte rüsten die Hersteller meist mit 5-MP/16-Bit-Kameras aus, die eine Auflösung von 5 Megapixeln erreichen und jedes Pixel mit 216 oder 65.536 Graustufen darstellen können. Für die Vorzeige-Systeme, die oft mit zusätzlichen Nahinfrarot (NIR)-Lasern und farbigen RGB-LEDs für die Epi-Beleuchtung aufgemotzt werden, reichen diese einfacheren Kameras nicht aus. Hier sind meist gekühlte 9- oder 12-MP-Kameras eingebaut, die auch bei spezielleren Anwendungen eine maximale Bildqualität liefern, etwa bei der Visualisierung mehrfarbiger Western Blots mit NIR-Laserlicht und RGB-LEDs.
Noch sind in den meisten Gel-Dokumentations-Systemen Kameras mit Ladungs-gekoppelten (CCD)-Sensoren installiert, die bereits Ende der Sechzigerjahre erfunden und seither kontinuierlich weiterentwickelt wurden. CCDs bestehen im Wesentlichen aus einem Silizium-Chip, auf dem ein sehr engmaschiges Gitter aus einzelnen Photodioden untergebracht ist, die jeweils ein Pixel bilden. Fallen Lichtquanten auf die Photodioden, erzeugen sie elektrische Ladungen beziehungsweise Photoelektronen, die zunächst wie in einem Eimer in den Pixeln gesammelt und danach zu festgelegten Zeitpunkten ausgelesen werden. Dazu wandern die Ladungspakete immer schön der Reihe nach Pixel für Pixel zu einem Sammelpunkt am Rand des Sensors. Dort wandelt ein Kondensator die Ladungen in elektrische Spannungen um, die in der Kamera schließlich ein Bild erzeugen.
Pixelgenaue Bilder
Das serielle Verschieben der Ladungspakete kostet Zeit und bremst die Aufnahmegeschwindigkeit von CCD-Kameras etwas aus. Die Umwandlung der Ladungspakete in eine Spannung läuft aber für alle Pixel gleich ab, wodurch CCD-Sensoren äußerst einheitliche beziehungsweise pixelgenaue Bilder erzeugen. Hinzu kommt, dass CCDs sehr lichtempfindlich und auch nicht allzu teuer sind.
Für die Hersteller von Gel-Dokumentations-Systemen gab es deshalb lange Zeit keinen Grund, auf sogenannte Complementary Metal Oxide Semiconductor-, kurz CMOS, -Sensoren umzusteigen. Diese machen CCDs seit den Neunzigerjahren Konkurrenz und haben inzwischen das Rennen in der Unterhaltungselektronik klar für sich entschieden – in Smartphone, Tablet und Co. sind heute durch die Bank CMOS-Kameras eingebaut. Die großen Chip-Hersteller haben deshalb beschlossen, in Zukunft komplett auf CMOS-Sensoren zu setzen und die Produktion von CCD-Sensoren 2025 auslaufen zu lassen. Spätestens zu diesem Zeitpunkt könnte es für die Produzenten von Gel-Dokumentations-Systemen schwieriger werden, sogenannte Scientific-Grade-CCDs aufzutreiben, die für wissenschaftliche Kameras geeignet sind.
Bisher findet man aber nur ganz vereinzelt Instrumente, die CMOS-Sensoren für die Visualisierung von Gelen einsetzen. Zu diesen gehört der Imager eines britischen Herstellers, der sich aber nicht nur durch die CMOS-Sensoren von klassischen Kamera-basierten CCD-Systemen unterscheidet. Er ist ebenso flach und kompakt wie ein Gel-Scanner und kommt wie diese ohne Kamera aus. Die fluoreszierenden oder chemilumineszierenden Gel-Banden werden jedoch nicht mit Photomultiplier-Röhren detektiert, wie in typischen Gel-Scannern, sondern mit CMOS-Sensoren. Letztere sind in einem schmalen Linien-Sensor untergebracht, der linear in einem Abstand von wenigen Millimetern über die Oberfläche des Gels gleitet und dabei Lichtsignale einfängt, die von den Gel-Banden ausgehen.
CMOS-Sensoren funktionieren ganz ähnlich wie CCD-Sensoren – mit einem wesentlichen Unterschied: Die von den Photodioden erzeugten Ladungen werden direkt in jedem einzelnen Pixel in eine Spannung für die Bilderzeugung umgewandelt. Die Bildaufnahme verläuft hierdurch wesentlich schneller als in CCD-Sensoren. Da auch die Kosten von CMOS-Sensoren deutlich gesunken sind und die Entwickler es zudem geschafft haben, störendes Hintergrundrauschen zu reduzieren, spricht sehr vieles für ihren zukünftigen Einsatz in Gel-Dokumentations-Systemen.
Das beste System nützt aber nichts, wenn der Anwender die tolerierbaren Grenzen der Bildbearbeitung bewusst oder unbewusst überschreitet. Dass hier einiges im Argen liegt, lassen verschiedene Studien vermuten, die in den letzten Jahren veröffentlicht wurden. Jüngstes Beispiel ist eine Untersuchung des Systembiologen Enrico Bucci von der Temple University in Philadelphia (Cell Death Dis. 9: 400).
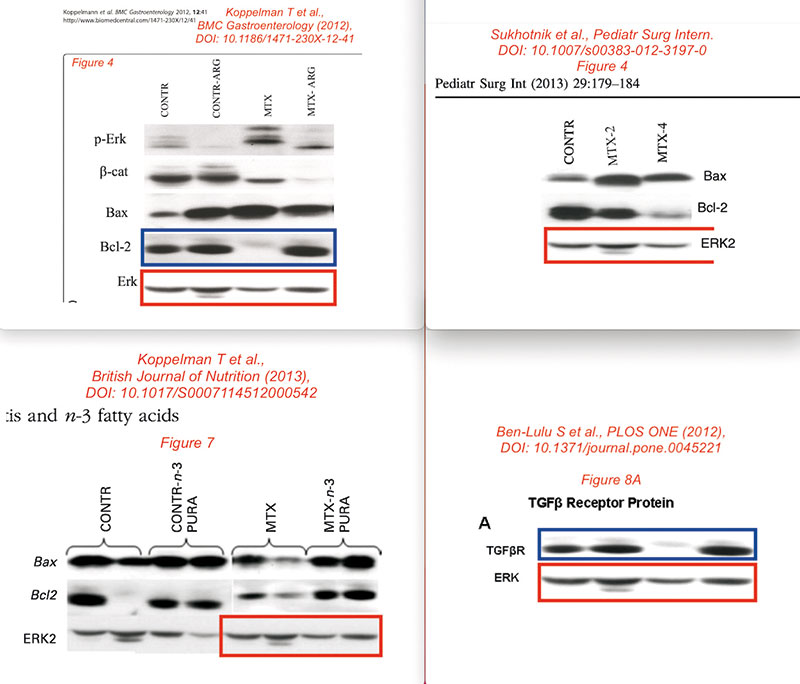
Bucci durchsuchte 1.364 Paper, die von 451 zufällig ausgesuchten biowissenschaftlichen Journalen stammten, mit einer speziellen Software auf manipulierte Abbildungen. Anschließend schaute er die Bilder nochmal mit eigenen Augen genauer an, die das Computerprogramm als verdächtig einstufte. In 78 Veröffentlichungen stieß er auf mindestens eine frisierte Abbildung, der größte Teil davon (65) waren Bilder von Protein- oder Nukleinsäure-Gelen. Von 299 Papern mit mindestens einem Bild eines Gel-Elektrophorese-Experiments enthielten fast ein Viertel nicht akzeptable Abbildungen von Gelen. Bucci nahm diese ernüchternden Zahlen zum Anlass, in seiner italienischen Heimat die Agentur Resis zu gründen, die gefälschte Bilder und andere Unregelmäßigkeiten in wissenschaftlichen Publikationen aufspürt.
Absicht oder Unerfahrenheit?
Nicht immer sollte man jedoch gleich böse Absicht bei zweifelhaften Abbildungen von Gelen oder Blots unterstellen. In vielen Fällen dürfte der Grund auch Unerfahrenheit oder Überforderung durch die zumeist sehr umfangreichen Bildanalyse-Programme sein. Da genügt es manchmal schon, den Kontrast bei Gel-Banden etwas zu sehr anzuheben und schon läuft man Gefahr, die Abbildung zu manipulieren. Wie sich Fehler bei der Bildanalyse und -bearbeitung vermeiden lassen, erklären Kota Miura und Simon Nørrelykke vom Nikon Imaging Center der Universität Heidelberg beziehungsweise der ETH Zürich in einem lesenswerten Commentary-Artikel in der Februar-Ausgabe des EMBO Journals (40:e105889). Wenn man sich dann noch durch die Manuals und Software-Beschreibungen der Gel-Dokumentations-Systeme durchgekämpft hat, sollte bei der Analyse und Dokumentation von Gelen und Western Blots eigentlich nichts mehr schiefgehen.
Gel-Dokumentations-Systeme im Überblick 
(Erstveröffentlichung: H. Zähringer, Laborjournal 4/2021, Stand: März 2021, alle Angaben ohne Gewähr)
Letzte Änderungen: 08.04.2021