Kommissar Durchflusszytometer
Durchflusszytometrie 2
Hanna Hartmann
Apoptoseforscher wollen wissen ob ihre Zellen durch Mord oder Selbstmord sterben. Hanna Hartmann weiß, wie das Durchflusszytometer die Aufklärung erleichtert.
Das Wort Apoptose stammt aus dem Griechischen und beschreibt das Fallen der Blätter im Herbst. Zellbiologen verstehen unter Apoptose den kontrollierten Selbstmord von Zellen. Ohne den apoptotischen Zelltod kämen wir mit Schwimmhäuten auf die Welt und Tumorzellen könnten ungehemmt wachsen. Auch bei Krankheiten wie Parkinson und Alzheimer, bei denen Nervenzellen vorzeitig absterben, nimmt die Apoptose eine Schlüsselposition ein.
Im Gegensatz zum Tod durch Nekrose, der die Zellen meist unverhofft durch äußere Einwirkungen wie Verbrennung, Vergiftung oder mechanische Verletzung der Zellmembran ereilt, läuft bei der Apoptose ein fein gesteuertes Zellprogramm ab, das ausgesuchte Zellen in den Selbstmord treibt. Apoptotische Zellen ändern schrittweise ihre Morphologie. Zuerst schrumpfen sie und bilden Membranausbuchtungen, später kondensiert das Chromatin und Endonukleasen fragmentieren die DNA. Die Zellmembran bleibt aber erhalten. Bei der Apoptose findet, im Gegensatz zur Nekrose, keine Immunreaktion statt. In aller Regel begehen nur einzelne Zellen, die überflüssig, alt oder beschädigt sind, Selbstmord.
Zelluläres Aufräumkommando
Apoptose ist ein zellulärer Prozess, der für Ordnung in unserem Körper sorgt. Deshalb beschäftigen sich auch Scharen von Forschern mit der Apoptose und ihrer Regulation. Dabei verwenden sie häufig den Fadenwurm Caenorhabditis elegans als Modellorganismus. Doch gibt es eine hervorragende Alternative zu den kleinen Würmern - das Durchflusszytometer.
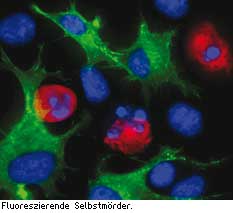
Im Durchflusszytometer kann man erkennen, wie die Zellen in der Anfangsphase der Apoptose schrumpfen und eine leicht granuläre Oberfläche bekommen.Dies bereits ohne die Zellen anzufärben. Innerhalb weniger Stunden verkleinern sich die Zellen immer mehr und die Granularität nimmt ab, bis am Ende nur noch winzige apoptotische Partikel, so genannte Apoptotic Bodies, übrigbleiben. Zur genauen Abgrenzung von apoptotischen Zellen werden inzwischen eine Vielzahl von Kits und Fluoreszenzfarbstoffen für das Durchflusszytometer angeboten.
Verräterische DNA-Brüche
Zum Beispiel ist es möglich, die Brüche in der DNA apoptotischer Zellen nachzuweisen. Das geht prima mit der TUNEL-Methode. TUNEL steht für "Terminale Desoxyribosyl-Transferase mediated dUTP Nick End Labeling". Klingt kompliziert, ist es aber nicht. Bei der TUNEL-Methode markiert man die freien 3'-OH Enden der gebrochenen DNA mit fluoreszierenden Nukleotiden. Da apoptotische Zellen eine stärkere TUNEL-Fluoreszenz aufweisen als gesunde Zellen, kann man sie im Durchflusszytometer leicht voneinander unterscheiden. Im Prinzip können Sie mit der TUNEL-Methode jede einzelne apoptotische Zelle identifizieren. Einziger Nachteil: Die Inkubation mit dem TUNEL-Reagenz bei 37 °C dauert recht lange, und die Zellen müssen vorher und nachher ordentlich gewaschen werden.
Eine weitere, weniger bekannte Möglichkeit zum Nachweis von DNA-Strangbrüchen veröffentlichte I. Nicoletti 1991 im J. Immunol. Methods. Dabei wird die DNA mit Propidiumjodid (PJ) angefärbt. Nicolettis Methode nutzt die Tatsache aus, dass Zellkerne von apoptotischen Zellen DNA freisetzen. Der DNA-Gehalt in den Kernen apoptotischer Zellen ist dadurch niedriger als der in "normalen" Zellen. Man spricht auch von hypodiploiden Zellkernen.
Neben Propidiumjodid enthält der hypotone Nicoletti-Puffer Triton X-100. Damit erreicht man, dass nur die Zellmembran, nicht aber die Kernmembran lysiert wird. Die intakten Zellkerne treten aus der Zelle aus und man kann ihren DNA-Gehalt im Durchflusszytometer messen. Weil die Zellen lysiert sind, können sie ohne Probleme länger auf Eis stehen bleiben. Das ist praktisch, wenn das Durchflusszytometer mal wieder stundenlang von Kollegen besetzt ist.
Wer die Apoptose bereits vor der Fragmentierung der DNA nachweisen will, kann hierzu Bisbenzimid (Hoechst 33342) verwenden. Dieser Fluoreszenzfarbstoff diffundiert durch die Plasmamembran von gesunden Zellen und bindet an die kleine Furche der DNA. Die Kondensation des Chromatins in apoptotischen Zellen führt dazu, dass diese stärker blau fluoreszieren als gesunde Zellen. Nekrotische Zellen können Sie mit PJ abgrenzen, das nur defekte Membranen passieren kann. Aber Vorsicht! Wie fast alle DNA-Farbstoffe ist auch Hoechst 33342 krebserregend. Und noch ein Manko: nicht jedes Durchflusszytometer kann blaue Fluoreszenz messen.
Auch Veränderungen in der Plasmamembran apoptotischer Zellen lassen sich für den Nachweis im Durchflusszytometer ausnützen. Die Membran ist in "normalen" Zellen asymmetrisch aufgebaut. So befindet sich zum Beispiel das Phospholipid Phosphatidylserin (PS) immer auf der Innenseite. Nur bei apoptotischen Zellen tritt PS auch auf der Außenseite auf. Diese Veränderung der Zellmembran dient als so genanntes "Eat-me-Signal" für Makrophagen. (Durch die Phagozytose der apoptotischen Zellen kommt es zu keiner unkontrollierten Freisetzung von Zellbausteinen. Eine Entzündungsreaktion, die auch benachbarte gesunde Zellen schädigen würde, wird so verhindert).
Mit Hilfe des fluoreszenzmarkierten Proteins Annexin V, das an das Phosphatidylserin auf der Membranaußenseite bindet, können Sie die apoptotischen Zellen im Durchflusszytometer nachweisen. Die Membran von nekrotischen Zellen ist für Annexin V durchlässig. Sie müssen deshalb eine zusätzliche Ausschluss-Färbung mit PJ durchführen, um nekrotische von apoptotischen Zellen unterscheiden zu können. Vorsicht bei adhärenten Zellen! Durch zu starkers Abschaben der Zellen oder stundenlanges behandeln mit Trypsin kann die Zellwand beschädigt werden. Dies kann zu falschpositiven Ergebnissen bei der Analyse der Zellen mit dem Durchflusszytometer führen. Bei einem unerwartet hohen Prozentsatz an apoptotischen Zellen sollten Sie stutzig werden. Kontrollieren Sie dann die Morphologie der Zellen unter dem Mikroskop.
Rote Mitochondrien
Wenn Sie frühe Ereignisse in der Apoptosekaskade messen wollen, sollten Sie einen Blick auf die Mitochondrien werfen. Zu den frühesten Veränderungen im apoptotischen Prozess gehört der Verlust des mitochondrialen Membranpotentials durch Porenbildung in der Mitochondrienmembran. Den elektrochemischen Gradienten können Sie mit dem lipophilen, kationischen Fluoreszenzfarbstoff JC-1 messen, der sowohl Plasma- als auch Mitochondrienmembran passiert.
In gesunden Zellen reichert sich JC-1 im stark negativ geladenen Inneren der Mitochondrien an und bildet dort rot fluoreszierende Aggregate. Wegen des verringerten mitochondriellen Membranpotentials kann der Farbstoff in den Mitochondrien in apoptotischen Zellen keine Aggregate formen. Stattdessen bleibt er als grün fluoreszierendes Monomer im Zellplasma zurück. Die Verschiebung im Emissions-Spektrum mißt das Durchflusszytometer. Diese Methode ist zuverlässig, vorausgesetzt die Zellen werden vor und nach der JC-1-Inkubation gut gewaschen.
Apoptose-Schnelltest
Einfacher und schneller ist die Färbung mit dem rot fluoreszierenden TMRE. TMRE ist wie JC-1 ein membranpermeabler, kationischer Fluoreszenzfarbstoff, der sich in Mitochondrien mit intaktem Membranpotential ansammelt. Die Anhäufung von TMRE führt zur Löschung (Quenchen) der Fluoreszenz. In apoptotischen Zellen diffundiert der Farbstoff jedoch aus den Mitochondrien heraus ins Zellplasma, weil in apoptotischen Zellen das Membranpotential zusammengebrochen ist.
Die TMRE-Fluoreszenz apoptotischer Zellen können Sie deshalb ungequencht vermessen. TMRE wird einfach auf die Zellkultur gegeben. Dann die Zellen für knappe 15 Minuten in den Brutschrank, und schon kann das Ganze gemessen werden. Keine einzige Zentrifugation! Schneller geht's wirklich nicht. Auch hier müssen Sie mit der PJ-Methode nekrotische Zellen von apoptotischen abgrenzen. Dabei ist ein wenig Spielerei am Durchflusszytometer nötig, weil die beiden roten Fluoreszenzen sauber getrennt werden müssen.
Fazit: Mit der Durchflusszytometrie kann man schnell große Zellmengen überprüfen und die Beschaffenheit jeder einzelnen Zelle charakterisieren. Dadurch lassen sich verschiedene Aspekte der Apoptose einfach und in vitro untersuchen. Um fragliche Daten abzusichern, sollten Sie dennoch die Mikroskopie nicht außer Acht lassen. Denn auch die Morphologie von Zellen ist ein verlässliches Kriterium für deren Vitalität.
Letzte Änderungen: 24.04.2006