Noch mehr Isoelektrische Fokussierung
Frei und doch fokussiert
von Hubert Rehm
Unser Proteinmethodiker Hubert Rehm hat beim letzten Bibliotheks-Screening so viel Neues zur Isoelektrischen Fokussierung (IEF) gefunden, dass er dem freien Fluss der Proteine" im letzten Laborjournal 10/2002 gleich noch zwei weitere geniale Methoden nachschiebt. Et voilà!
Die letzte Folge beschrieb die Perfektionierung der isoelektrischen Fokussierung (IEF) in klassischen Freiflußelektrophorese-Geräten. Hier werden IEF-Methoden vorgestellt, die Acrylamidgele mit immobiliserten Ampholyten verwenden. Dennoch schwimmen die Proteine hinterher frei, glücklich und fokussiert in einer Lösung. Sie müssen sie nicht mehr mühsam aus dem Gel kratzen. Entsprechend stolz treten die Erfinder auf. Der Erste verspricht nichts Geringeres als einen Wendepunkt" in der Proteom-Analyse (Herbert und Righetti in Electrophoresis 21, S. 3639-3648). Stellen wir uns also auf diesen Wendepunkt und schauen wir uns um.
Eine Idee wie vom Metzger
Die Idee könnte von einem Metzger stammen. Eine Wurst in Scheiben (Fig.1): Die Scheiben werden von isoelektrischen Membranen (Acrylamid mit Immobilinen) jeweils eines bestimmten pHs, zum Beispiel 3,0, 4,0, 5,0, 6,0, und so weiter begrenzt. Es entstehen Kammern, gefüllt mit salzfreiem Medium, zwischen deren Wänden sich ein pH-Gradient ausbildet (zum Beispiel pH 3,0-4,0, pH 4,0-5,0 und so weiter). Die Probe wird in eine der Kammern gegeben. Es wird Strom angelegt und der Apparat durch Drehen in einem Kühlbad gekühlt. Die Proteine wandern solange durch die Membranen, bis sie in eine Kammer kommen, deren pH-Gradient ihren isolektrischen Punkt eingrenzt. Schwupp, sitzen sie in der Falle.
Auf diese Weise können Sie eine Proteinmischung in so viele Fraktionen auftrennen wie das Gerät Kammern hat. Fahren Sie von jeder Fraktion ein 2D-Gel, können Sie aus den 2D Gelen das Proteom zusammensetzen. Die Vorteile: Sie können auf ein 2D Gel, relativ gesehen, mehr Protein aufladen, sehen also auch seltene Proteine.

Sie haben es nicht auf eine Proteomanalyse abgesehen? Sie wollen ein Protein reinigen? Dann wählen sie die pHs der isoelektrischen Membranen so, daß der pH-Gradient einer Kammer den isoelektrischen Punkt ihres Proteins eng umfaßt. Dort sammelt sich ihr Protein dann an, oft porentief rein und zudem frei von Ampholyten. Die sind ja in den Membranen fixiert. Falls Sie auf Harnstoff im Medium verzichten und Glück haben, erhalten Sie das Protein sogar im nativen Zustand. Die Ausbeute soll bei über 90 Prozent liegen. Die Adsorption der Proteine an die isoelektrischen Membranen sei geringfügig, behaupten Herbert und Righetti, und sie müssen es wissen, denn sie haben die Membranen nach dem Lauf zermahlen und das adsorbierte Protein gemessen. Ergebnis: So gut wie nichts. Allerdings wurde in Gegenwart von Harnstoff, Thioharnstoff und Detergens fokussiert. Bei nativer IEF und geringen Proteinkonzentrationen dürfte wohl doch Protein adsorbieren. Dies kann man umgehen, indem man die Probe gleich in die Kammer gibt, deren pH-Gradient den isoelektrischen Punkt des gesuchten Proteins umfaßt (vorausgesetzt, Sie kennen den). Das gesuchte Protein bleibt dann in der Kammer und nur die Verunreinigungen wandern durch die Membranen davon, und ob die adsorbieren kann ihnen gleichgültig sein.
Eine Variation dieser Methode ist die Isoprime Anlage von Pharmacia. Das Herzstück besteht ebenfalls aus Kammern, aber deren isoelektrische Membranen werden auf Glasfasergerüste polymerisiert. (Dies stabilisiert die Membranen, aber andererseits – werden nicht Proteine an Glasfaserfilter adsorbiert?) Die Kammern werden nicht in einem Kühlbad gedreht, sondern der Inhalt jeder Kammer wird per Schlauchpumpe umgetrieben. Auch hier werden die Proteine säuberlich nach isoelektrischen Punkten in Fraktionen getrennt, die durch die pH-Werte der Kammermembranen bestimmt werden. Die pH-Werte können Sie frei wählen und die Fraktionen sind frei von Ampholyten. Geliefert wird die Anlage mit acht Kammern, aber für die Proteomanalyse wären Anlagen mit beliebig vielen Kammern denkbar, beispielsweise 96. Ein Vorschlag zur Güte: Warum die fünf Prozent Acrylamid Schlabbermembranen nicht durch haltbare, standardisierte isoelektrische Membranen ersetzen? Die anschließende 2D-Gelelektrophorese jeder Fraktion gäbe ein genaues und reproduzierbares Puzzle des Zellextrakts. Diese Methode wäre der Zoom 2D-Elektrophorese (in engen pH-Bereichen, etwa pH 5-6) überlegen. Beim Zoomen muß ja das gesamte Zellprotein auf ein 2D-Gel aufgeladen werden. Hier würde nur die Fraktion aufgeladen, die auch im Gel getrennt wird. Man kann vom einzelnen Protein mehr aufladen und die aus dem pH-Bereich herausfallenden Proteine stören nicht. Billig ist der Spaß nicht: Die Anlage mit acht Kammern kostet knapp 23 000 Euro.
Wenn das Geld knapp ist: Bitte lesen Sie hier weiter!
Als nächstes daher eine IEF-Methode für Arme. Sie wurde von Ros et al. in Proteomics 2002, 2, Seite 151-156 publiziert, nennt sich Off-Gel Electrophoresis und eignet sich weniger zur Proteom-Analyse als eher zur Reinigung einzelner Proteine.
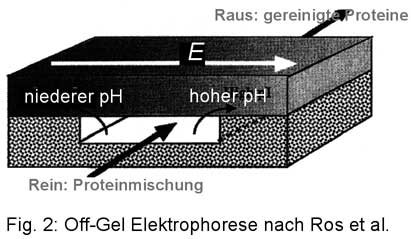
Die zugehörige Apparatur besteht aus einer flachen Laufkammer, deren eine Wand ein Gradientengel mit immobilisierten Ampholyten bildet (Fig. 2). Das Gel bestimmt daher den Kammer-pH. Senkrecht zur Laufkammer wird durch das Gel ein elektrisches Feld angelegt. Die Wirkung: Geladene Proteine werden in das Gel getrieben, ungeladene bleiben in der Laufkammer. Der pH-Bereich des die Laufkammer begrenzenden Gelstücks bestimmt, welche Proteine in der Kammer bleiben: die, deren isoelektrischer Punkt in den pH-Bereich fallen.
Ros et al. verwenden eine Laufkammer von 4 mm Weite, 0,6 mm Dicke und 40 mm Länge. Die Probe wurde mit einer peristaltischen Pumpe umgewälzt und nach 1-3 Stunden war die Fokussierung beendet. Demonstriert wurde das Prinzip mit einer Mischung von synthetischen pI-Markern und einem Protein (Eglin c), und weil sich die Autoren wohl gesagt haben, dass dies nicht viele überzeugt, gleich auch mit E. coli-Extrakt.
Die Vorteile der Off-Gel-Elektrophorese-Methode sind: Sie arbeitet mit kleinen Volumina (0,1 bis 1 ml) und hohen Proteinkonzentrationen (12 mg/ml); die Probe bleibt ampholytfrei und Sie können jeden beliebigen pH-Bereich wählen (das Wandgel verschieben!). Des weiteren muß die Probe keine Membran durchwandern. Falls ihre Probenproteine nicht in der Nähe des isoelektrischen Punktes ausfallen, brauchen Sie bei niedriger Proteinkonzentration keinen Harnstoff zusetzen: Ihr Protein wird ja nur in der Kammer umgewälzt. Nur die Verunreinigungen wandern ins Gel. Wie kommt man an so eine Anlage? Ganz einfach: Sie warten einen Moment ab, in dem ihr Werkstattmeister gerade guter Laune und nicht in der Vesperpause ist und lassen eine bauen.
Ein weiterer Nachteil ist, dass die Kammer keine großen Volumina umsetzen kann: Die Kammer darf nicht zu tief sein, weil sonst das Wandgel die Laufkammer nicht genügend puffert. Die 0,6 mm von Ros et al. sind wahrscheinlich schon das höchste der Gefühle. Die Laufkammer fasst also nur 0,1 ml Flüssigkeit und deswegen ist es wenig sinnvoll, mehr als 1 ml Probenvolumen umzuwälzen. Damit wir uns recht verstehen, es ist nicht unmöglich: Sie können auch 10 ml umwälzen, aber bis sich das Gleichgewicht eingestellt hat, das dauert dann Tage. Bei Extrakten mit hoher Proteinkonzentration müssen Sie Harnstoff zugeben. Tun Sie's nicht, fallen ihnen die ins Gel auswandernden Proteine womöglich an der Geloberfläche aus. Und nicht vergessen: Die Proteine, die in der Laufkammer bleiben, schwimmen in der Nähe ihres isoelektrischen
Punktes und das weckt ihren Gemeinschaftssinn. Geradezu
genial in ihrer Einfachheit und Wirksamkeit scheint mir eine Erweiterung der Off-Gel-Elektrophorese, die in www.diagnoswiss.com angedeutet wird. Wenn ich das Ganze richtig verstanden habe, nimmt man eine 96er Mikrotiterplatte, pipettiert die Probe in eine Reihe Wells ein, legt ein Gel mit immobilisierten Ampholinen auf, drückt es an und dreht es um. Das Gel dichtet die Wells mit den Proben ab, die Proteine können aber, über das Gel, von einem Well zum anderen wandern. Das tun sie auch, wenn Sie an den Enden der Well-Reihe Spannung anlegen. So können Sie ihre Probe schnell und billig in – eigentlich beliebig viele – Fraktionen auftrennen. Vielleicht bringt's ja was.
Letzte Änderungen: 08.09.2004