Kontaminationen in der Zellkultur II
Die sieben Plagen sind eigentlich fünf
von Sabine Pils
Die in Laborjournal 5/2002 thematisierten Mycoplasmen sind leider nicht die einzigen Schreckgespenster in der Säugerzellkultur. Genauso häufig, aber wahrscheinlich weniger bekannt sind Nanobakterien und deren L-Formen. Und auch weniger exotische Plagen wie Hefen, Pilze und normale Bakterien" verursachen Infektionen und stellen selbst den erfahrenen Experimentator auf eine harte Geduldsprobe.
Bei den Recherchen zu den L-Formen und Nanobakterien bin ich auf zum Teil irreführende Informationen gestossen. Am Ende hatte ich sogar den Eindruck gewonnen, dass manchmal beide in den gleichen Topf geworfen werden. Tatsächlich muss man aber zwischen L-Formen und Nanobakterien unterscheiden.
Doch zunächst erst einmal zu den bakteriellen L-Formen. Diese sind schon relativ lange bekannt und haben ebenso wie die Mycoplasmen keine Zellwand, abgesehen davon aber sonst wenig mit den Mycoplasmen gemein. L-Formen stellen eine modifizierte Form normaler Bakterien dar, die unter fehlerhaften Kulturbedingungen entstehen. Woher aber stammt der Begriff L-Form"?
Unter bestimmten Umständen, nämlich bei Grenzkonzentrationen von Penicillin im Medium, vermehren sich Stäbchenbakterien nicht durch Querteilung, sondern bilden Ausbuchtungen an den Teilungsstellen. Es bilden sich dort bläschenförmige Gebilde von etwa 10 µm Grösse, aber auch noch weitaus winzigere Bläschen. Diese bilden keine Zellwand sondern Membranen aus und können einen Sterilfilter passieren. In Gegenwart von Penicillin sind sie in der Lage sich zu vermehren und bilden auf Nähragar kleine, etwa 0,5 Millimeter grosse Kolonien. Entdeckt wurden die L-Formen 1935 von E. Klieneberger-Nobel in Streptobacillus-Kulturen. In diesen Kulturen waren die L-Formen bereits spontan, ohne Anwesenheit von Penicillin entstanden (das L steht für die Abkürzung Lister-Institut in London). Zwar habe ich selbst noch keine L-Formen in meinen Kulturen gesichtet, aber mir wurde berichtet, dass man sie diagnostizieren kann. Im Gegensatz zu den Nanobakterien soll man die L-Formen unter dem Mikroskop als Schlier oder feines Netzwerk erkennen können.
Auch das noch: Nanobakterien
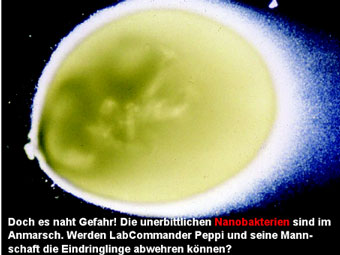
Nanobakterien sind auch mir erst seit meinem Mycoplasmenproblem bekannt. Ein Aussendienstler einer Laborbedarfsfirma hat mich auf sie aufmerksam gemacht, als ich mit ihm über unsere verseuchten Zellkulturen diskutierte. Die haben mir gerade noch gefehlt!" war mein erster Gedanke. Nanobakterien sind nicht so bekannt und auch nicht so einfach diagnostizierbar wie die L-Formen. In der Fachliteratur wird beschrieben, dass sie im Verdacht stehen beim Menschen Nierensteine, Gallensteine und Verstopfungen der Herzkranzgefässe zu verursachen. Da aber die wenigsten Experimentatoren Gallensteine in der Zellkultur züchten, stellt sich die Frage, wie diese Bakterien in die Kultur gelangen. Trotz der Möglichkeit, serumfreie Medien zu verwenden, wird in den meisten Fällen tierisches Serum als Nahrungsquelle für die Zellen angeboten. Genau über diesen Weg, nämlich durch die Seren gelangen die Nanobakterien in die Kultur. Etwa 90% aller Seren und Blutprodukte, egal von welchem Hersteller, sind mit diesen Bakterien kontaminiert. Sie entwickeln sich ca. drei bis sechs Wochen nach dem Auftauen des Serums. Natürlich werden die Seren von allen Anbietern filtriert und getestet, letzteres allerdings meist schon kurze Zeit nach dem Auftauen einer Testflasche und damit häufig für einen zuverlässigen Nachweis zu früh.
Ein charakteristisches Merkmal dieser Bakterien aber ist, dass sie wie auch die Mycoplasmen durch einen Sterilfilter passen. Selbst bei einer Porengrösse von 70 Nanometer schlüpfen noch einige dieser winzigen Plagegeister hindurch. Nahe an der Grenze zur Ultrafiltration dagegen sind Filter mit einer Porengrösse von 40 nm. Da in diesen Filtern Nanobakterien wirkungsvoll zurückgehalten werden, kommen sie inzwischen bei vielen Anbietern zum Einsatz. Allerdings bleiben auch andere funktionelle Stoffe des Serums im Filter hängen, was dann wiederum ein beeinträchtigtes Zellwachstum zur Folge hat. Vielleicht hat der ein oder andere Experimentator nach einem Wechsel der Serumcharge auch schon ein schlechteres Wachstum seiner Zellen beobachtet. Wie man es auch dreht und wendet, irgendwo scheint immer ein Pferdefuss zu sein. Selbst durch eine hochdosierte Gammabestrahlung werden diese Bakterien nicht abgetötet.
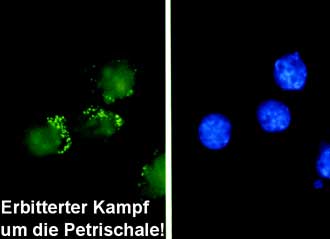
Was kann man also tun? Zunächst einen kühlen Kopf bewahren! Ein Vorteil ist, wenn man in einem solchen Fall überhaupt davon sprechen kann, dass Nanobakterien meist sehr langsam wachsen und daher in den wenigsten Fällen die Kultur überwachsen. Nur wenn sie in ausreichend hohen Konzentrationen relativ zur Zellzahl auftreten, besteht potentielle Gefahr. Vermutet wird laut Literatur, dass Nanobakterien von den Säugerzellen durch Rezeptor-vermittelte Endozytose aufgenommen werden. Erste zytopathische Effekte wurden bei Fibroblasten beobachtet, die mehr als 100 Nanobakterien pro Zelle aufgenommen hatten. Ähnlich wie bei einer Mycoplasmen-Infektion kann eine verstärkte Vakuolisierung, begleitet von schlechtem Wachstum bis hin zu apoptotischen Veränderungen beobachtet werden.
Wer seine Kulturen auf diese ständigen Begleiter testen möchte, kann das am einfachsten mit einem Farbtest tun. Der Test beruht auf dem Nachweis von bakteriellen Nukleinsäuren, die mit dem Farbstoff Bisbenzimid (Hoechst 33258) angefärbt werden und funktioniert analog wie ein DAPI-Test zum Mycoplasmennachweis. Erheblich zuverlässiger aber sind andere Techniken wie Elektronenmikroskopie, Immunfluoreszenz oder ein ELISA mit monoklonalen Antikörpern gegen Nanobakterien.
Zugegeben: Es ist beruhigend zu wissen, dass die Nanos" die Zellkulturen in der Regel nicht überwachsen und daher keine unmittelbare Gefahr besteht. Dennoch kann man etwas unternehmen und seine Kulturen säubern. Ein dafür geeignetes Mittel wird beispielsweise vom französischen Hersteller BioWest angeboten, welches generell bei den besonders tückischen Plagegeistern helfen soll. Mycoplasmen, L-Formen und sogar Nanobakterien sollen damit wirksam abgetötet werden. Das Produkt mit dem schönen Namen Nanomycopulitine" kann über den deutschen Händler, die Firma Invitromax, bezogen werden. Die wirksame Substanz ist ein Toxin, welches die Organismen sowohl in der Wachstumsphase als auch in der stationären Phase des Lebenszyklus abtöten soll. Mir liegen allerdings keine eigenen Erfahrungen damit vor.
Keine Rettung bei trüben Wolken
Anders liegt der Fall wenn man feststellen muss, dass nicht die unauffälligen Nanobakterien die Zellkulturen heimgesucht haben, sondern ganz normale Bakterien", wie etwa Stäbchenbakterien. Ein Blick auf das Medium in der Zellkulturflasche bzw. unter das Mikroskop verrät unverkennbar: Bakterienkontamination! Das Medium ist trüb und wolkig, der Farbumschlag des Indikators im Medium nach gelb lässt erkennen, dass die Bakterien alle Nährstoffe verbraucht haben und das Milieu durch die Stoffwechselgifte sauer geworden ist. Grund sauer zu sein hat auch der Experimentator, denn in diesem Fall gibt es wirklich keine Rettung. Am Beginn meiner Arbeiten mit Zellkulturen habe ich einmal in einem Anfall von Naivität versucht, Bakterien durch häufigen Mediumwechsel auszudünnen und gleichzeitig ein Antibiotikum zugegeben. Aber bei einer bakteriellen Verdopplungszeit von ca. 20 Minuten kann man sich ausrechnen, wie erfolgreich ein solcher Rettungsversuch ist. Alle Antibiotika dieser Welt können da nichts mehr ausrichten, also weg mit der verseuchten Kultur!
Sofort nach dem Feststellen einer Bakterieninfektion sollte man überprüfen, ob wirklich nur eine Kultur betroffen ist oder nicht doch die Kontamination auf den Gebrauch eines kontaminierten Mediums oder einer Lösung zurückgeht, was einen weitaus grösseren Schaden verursacht. Generell empfiehlt es sich die sterile Arbeitsweise regelmässig durch Sterilitätskontrollen der benutzten Puffer, Lösungen und Medien zu überprüfen.
Eine Bakterieninfektion kann aber auch durch eine nachlässige Arbeitsweise des Experimentators selbst eingeschleppt werden. Staphylokokken zum Beispiel sind Bestandteil der normalen Hautflora und befinden sich demnach auch auf unseren Hautschüppchen. Es sollte zwar immer peinlich vermieden werden, während der Arbeit an der Sterilbank über offenen Zellkultur- und Mediumflaschen oder den dazugehörenden Deckeln zu hantieren, aber der ein oder andere stopft sich die Arbeitsfläche unter der Bench so voll, dass genau das nicht vermieden werden kann. In diesem Fall lohnt es sich nicht, aus Zeitgründen allzu viele Kulturen gleichzeitig zu bearbeiten, denn das geht garantiert in die Hose oder besser gesagt in den Mülleimer. Weitere Auslöser für Infektionen können Flaschenhälse sein, die versehentlich berührt wurden bzw. Pipettenspitzen, die in den vorderen schon gefährlich unsterilen Bereich der Flowbox gebracht wurden. Solche Missgeschicke sind typische Anfängerfehler, die man aber nach leidvoller Erfahrung mit aufgetretenen Infektionen schnell ausmerzt.
Was häufig unterschätzt wird ist, dass hüstelnde und niesende Mitarbeiter oder Personen mit chronischen Atemwegsinfekten häufig selbst eine potentielle Kontaminationsquelle darstellen. Gerade in der Erkältungszeit ist das durchaus nicht abwegig und man sollte auch mal über die eigene Arbeitsweise nachdenken, wenn man ungeniert vor sich hin prustet oder in einem Anfall von Redseligkeit die Ereignisse vom Vorabend ausgerechnet an der Sterilbank mit den Kollegen austauscht. Darüber hinaus sollte Publikumsverkehr um die Flowbox während der sterilen Arbeiten nach Möglichkeit vermieden werden.
Eine beliebte Brutstätte für Keime jeglicher Art, besonders aber für Pilze sind Mediumtropfen, die sich an Flaschenhälsen befinden oder von dort meist unbemerkt auf die Stellflächen des Brutschranks getropft sind. Solche Tropfen sind geradezu ein gefundenes Fressen für Keime, die sich darin fröhlich vermehren und dann eine Flächenkontamination verursachen. Daher sollte gerade nach dem Transport der Kulturflaschen, besonders aber von Petrischalen in den Inkubator, nach Mediumtropfen, die sich auf den Ablagen befinden, Ausschau gehalten werden.
Tückisch: Feuchte Inkubatoren
Aber nicht nur die Tropfen allein machen Probleme. Besonders tückisch ist die Kombination von Mediumtropfen in Inkubatoren mit extrem feuchter Atmosphäre. Gerade im Sommer kann man nach einiger Zeit beziehungsweise nach häufigem Öffnen der Tür feststellen, dass das Wasserreservoir im Brutschrank (gerade bei älteren Modellen) schneller als üblich verkeimt. Das trifft auch auf die obligatorischen Wasserbäder zur Erwärmung der Medien zu. Dort sammeln sich nur allzu gern Pilzsporen, die vorzugsweise in der warmen Jahreszeit Probleme bereiten. Das kann zum Beispiel daher rühren, dass aufgrund der Wärme in vielen Labors entgegen den Sicherheitsvorschriften die Fenster geöffnet werden. Das ist zwar in der Regel in einem Zellkulturlabor nicht der Fall, dennoch wird durch den im allgemeinen vermehrt auftretenden Luftzug mehr Staub aufgewirbelt und damit die Kontaminationsgefahr erhöht.
Pilzinfektionen sind leicht an den langen Hyphen zu erkennen, die man schon mit blossem Auge bei der Betrachtung der Zellkulturflasche unter dem Inversmikroskop erkennen kann. In diesem Stadium kann man noch versuchen, etwas zu retten, indem man ein Antimycotikum zugibt. Entdeckt man dagegen ein faseriges Gebilde, das an einen winzigen Wattefussel erinnert, ist das ein untrügliches Zeichen für eine Pilzinfektion, die in diesem Stadium bereits in grossem Umfang Sporen bildet. In diesem Fall ist es klüger auf die betroffene Kultur zu verzichten und keine Rettungsversuche zu unternehmen, da sich die Sporen bereits beim Öffnen der Flasche über die Luft verbreiten können. Die betroffene Flasche sollte sofort vernichtet werden. Ist nicht nur eine Zellkulturflasche befallen, sondern sogar eine Flächenkontamination beispielsweise im Brutschrank ausgebrochen, sollte die Pilzinfektion mit einem geeigneten Desinfektionsmittel behandelt werden. Hier helfen in der Regel nur sorgfältig durchgeführte Reinigungsaktionen, wie sie schon beim letzten Mal ausführlich bei den Mycoplasmen beschrieben wurden.
Ein weiteres Übel sind Kontaminationen mit Hefen. Ohne den Experimentatoren, die fleissig mit Hefen arbeiten zu nahe treten zu wollen – Hefen sind in Säugerzellkulturen ebenfalls eine Kontamination. Diese Mikroorganismen gehören zur Gruppe der einzelligen Pilze (Fungi imperfecta). Der Durchmesser dieser winzigen Unholde ist etwa fünf bis zehn mal kleiner als der von Säugerzellen. Die einzelnen Hefezellen sind rund, oval oder birnenförmig und bilden bei der Vermehrung auch kleine Reihen aus, die wie eine Perlenkette aussehen. Wer jetzt glaubt, er habe eine besonders wertvolle Kultur, der irrt sich. Hefen steigern den Wert einer Kultur in keinster Weise, ganz im Gegenteil. Auch bei einer Hefenkontamination kann man versuchen etwas zu unternehmen und ein Antimycotikum zugeben, jedoch ist zu beachten, dass diese Agenzien wiederum für einige Zellen toxisch sind. Daher ist die Verwendung solcher Substanzen nur für den kurzzeitigen Einsatz in der Zellkultur zu empfehlen.
Wie kommt die Hefe in die Kultur?
Der Verbreitungsmechanismus von Hefen ist der gleiche wie bei anderen Pilzen, also vorwiegend über die Luft. Es gibt allerdings interessanterweise gerade für Hefen einen weiteren Infektionsweg. Als Deutschland von der Ökowelle überrollt wurde, war es unter anderem ziemlich trendy, sein Brot selbst zu backen. Das ist eigentlich weiter kein Problem, solange Anhänger von selbst gebackenem Brot nicht steril mit Zellkulturen arbeiten. Die sind dann nämlich nicht mehr unbedingt steril. Das hört sich weit hergeholt an? Keineswegs, das zeitgleiche Zusammentreffen dieser Gegebenheiten mit häufig wiederkehrenden Hefenkontaminationen ist sogar schon in der Fachliteratur beschrieben worden. Manchmal kommt man eben nicht auf die naheliegendsten Zusammenhänge, weil es einem schlichtweg zu banal erscheint. Generell kann man gegen Hefen, Pilze und Bakterien natürlich Breitbandpräparate einsetzen, allerdings ist man mit der ständigen Kontrolle der sterilen Arbeitsweise sicher besser beraten um sich vor solch lästigen Kontaminationen zu schützen.
Zum Schluss aber dennoch ein paar tröstende Worte. Es gibt wohl kein Zellkulturlabor, welches nicht schon mal mit dem ein oder anderen Kontaminationsproblem Erfahrung gesammelt hat. Das Aufspüren der verursachenden Quelle aber grenzt häufig schon an eine detektivische Meisterleistung. Bei Kontaminationen in kleinem Umfang lohnt es meist nicht, eine gross angelegte Ursachenforschung zu betreiben, wenn der Grund nicht offensichtlich ist.
Fazit: Zeit nehmen!

Wiederkehrende Kontaminationen dagegen sind ein ernst zu nehmendes Problem. Hier sollte schon etwas Zeit in die Kontrolle der sterilen Arbeitsweise und in die üblichen Vorsichtsmassnahmen investiert werden. Nur so kann verhindert werden, dass die Kulturen ständig durch Kontaminationen gefährdet sind. Tritt dennoch eine Infektion auf, muss entschieden werden, ob sich der Aufwand lohnt einen Rettungsversuch zu starten. Oftmals ist es einfacher, eine neue Charge der Zellen aus dem Flüssigstickstoff aufzutauen und mit diesen Zellen weiter zu experimentieren. Allerdings ist auch dieses Vorgehen keine Garantie für saubere Zellkulturen, wie man im letzten Beitrag zu diesem Thema nachlesen konnte. In Panik zu verfallen bringt aber auch nichts.
Egal für welches Vorgehen man sich entscheidet, ein kritischer Blick auf oft schon automatisierte Arbeitsschritte die man bis dahin als unproblematisch angesehen hat, kann einem oftmals die Augen öffnen. In diesem Sinne: Allen Experimentatoren viel Erfolg!
Die in diesem Artikel veröffentlichten Fotos wurden uns freundlicherweise vom finnischen Nanobakterien-Forscher Olavi Kajander zur Verfügung gestellt. Zu bewundern sind von Anfang bis Ende des Artikels:
- fluoreszenzgefärbte Nanobakterien
- Nanobakterien auf Löffler-Medium
- fluoreszenzgefärbte Fibroblasten mit Nanobakterien
- sESM-Bild von Nanobakterien auf einer 0,1 µm-Membran
Letzte Änderungen: 08.09.2004








 Wiederkehrende Kontaminationen dagegen sind ein ernst zu nehmendes Problem. Hier sollte schon etwas Zeit in die Kontrolle der sterilen Arbeitsweise und in die üblichen Vorsichtsmassnahmen investiert werden. Nur so kann verhindert werden, dass die Kulturen ständig durch Kontaminationen gefährdet sind. Tritt dennoch eine Infektion auf, muss entschieden werden, ob sich der Aufwand lohnt einen Rettungsversuch zu starten. Oftmals ist es einfacher, eine neue Charge der Zellen aus dem Flüssigstickstoff aufzutauen und mit diesen Zellen weiter zu experimentieren. Allerdings ist auch dieses Vorgehen keine Garantie für saubere Zellkulturen, wie man im letzten Beitrag zu diesem Thema nachlesen konnte. In Panik zu verfallen bringt aber auch nichts.
Wiederkehrende Kontaminationen dagegen sind ein ernst zu nehmendes Problem. Hier sollte schon etwas Zeit in die Kontrolle der sterilen Arbeitsweise und in die üblichen Vorsichtsmassnahmen investiert werden. Nur so kann verhindert werden, dass die Kulturen ständig durch Kontaminationen gefährdet sind. Tritt dennoch eine Infektion auf, muss entschieden werden, ob sich der Aufwand lohnt einen Rettungsversuch zu starten. Oftmals ist es einfacher, eine neue Charge der Zellen aus dem Flüssigstickstoff aufzutauen und mit diesen Zellen weiter zu experimentieren. Allerdings ist auch dieses Vorgehen keine Garantie für saubere Zellkulturen, wie man im letzten Beitrag zu diesem Thema nachlesen konnte. In Panik zu verfallen bringt aber auch nichts.