Gebärmaschine für Bakterien - Die Mother Machine
Andrea Pitzschke
(09.02.2020) Mit der Mother Machine können Forscher das Schicksal einzelner Zellen über viele Generationen
hinweg verfolgen. Besonders ausgeklügelt ist eine neuentwickelte Mother Machine, mit der man die beobachteten Zellen auch gleich noch isolieren kann.
In Bakterienkulturen scheint auf den ersten Blick eine Zelle der anderen zu gleichen. Bei genauerer Betrachtung sind sie aber sehr heterogen. Die Zellen sind unterschiedlich alt, stammen von verschiedenen Individuen ab und enthalten variierende Mengen an mRNAs, Proteinen sowie anderer zellulärer Komponenten. Dies wirkt sich unmittelbar auf wichtige zelluläre Prozesse aus, wie zum Beispiel Mutationsraten, Genexpression, Zellteilung und Wachstum.
Eine einzelne Zelle und deren Nachkommen über ihr Leben hinweg zu beobachten, ohne sie aus dem Auge zu verlieren, ist aber äußerst schwierig. Mit jeder Teilung sorgt die wachsende Anzahl an Tochter-, Enkel- und Urenkelzellen dafür, dass die ursprünglich untersuchte Zelle in der Anonymität verschwindet. Wie soll man da zum Beispiel dem Phänotyp einer Zelle den richtigen Genotyp zuordnen oder Verhaltensänderungen während der Alterung erkennen?
Übliche Untersuchungsmethoden für Einzelzell-Screenings, wie zum Beispiel die Durchflusszytometrie, liefern nur Momentaufnahmen, und DNA-Barcode-basierte Verfahren sind sehr aufwendig.
Einfaches Kanalsystem
Eine verblüffend simple und praktikable Lösung dieses Problems stellte die Gruppe des Biophysikers und Molekularbiologen Suckjoon Jun von der Harvard University, USA, bereits vor zehn Jahren vor: Sein Team konstruierte ein einfaches mikrofluidisches Gerät namens Mother Machine für die kontinuierliche Kultur von Bakterienzellen (Curr. Biol. 20(12): 1099-1103).
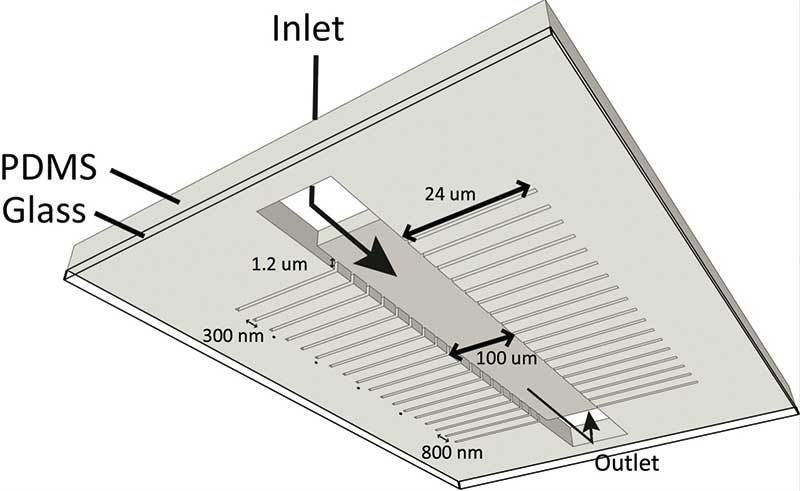
Die Form der Mother Machine ähnelt einem Fischskelett ohne Kopf und Schwanz: Von einem etwa 30 Millimeter langen, 25 Mikrometer hohen und 100 Mikrometer breiten Hauptkanal (Trench), durch den Nährmedium fließt, zweigen rechtwinklig in regelmäßigem Abstand von wenigen Mikrometern viele kleine Wachstumskanäle ab. Die Wachstumskanäle sind ungefähr einen Mikrometer hoch und breit sowie 25 Mikrometer lang und enden in einer Sackgasse.
Wird eine Zell-Suspension durch den Hauptkanal geleitet, gelangt diese durch Diffusion auch in die Wachstumskanäle, an deren Ende sich jeweils eine Bakterienzelle absetzt, die als Mutterzelle bezeichnet wird. Da der Wachstumskanal kaum breiter ist als die Bakterienzelle, kann sich diese nicht mehr vom Fleck rühren und sitzt am Ende der Sackgasse fest, wird aber vom Hauptkanal aus kontinuierlich mit frischem Nährmedium versorgt. Teilt sich die Mutterzelle, kann sich die Tochterzelle nur vom sogenannten Tochterpol der Mutterzelle aus in Richtung des Hauptkanals bewegen. Der am Ende der Sackgasse liegende Mutterpol wird auf diese Weise von einer Zellgeneration zur nächsten weitergegeben. Hierdurch erhöht sich das Alter der Mutterzelle bei jeder Zellteilung um eine Generation. Die mit zunehmendem Abstand von der Mutterzelle immer jüngeren Tochterzellen landen schließlich im Hauptkanal und werden von dem darin fließenden Nährmedium weitertransportiert.
Inzwischen wurde die Mother Machine von verschiedenen Gruppen weiterentwickelt und ihre Architektur an Mikroorganismen mit anderen Größen oder Generationszeiten angepasst.
Ein interessantes Modell mit zwei Hauptkanälen entwickelte ein Team um Erik van Nimwegen vom Biozentrum der Universität Basel sowie Gene Myers vom Max Planck Institut für Molekulare Zellbiologie und Genetik in Dresden (Nature Commun. 9: 212). Die Gruppe untersuchte mithilfe ihrer Dual Input Mother Machine am Beispiel des Lac-Operons, wie einzelne Bakterienzellen Genexpression und Wachstum an sich verändernde äußere Bedingungen adaptieren.
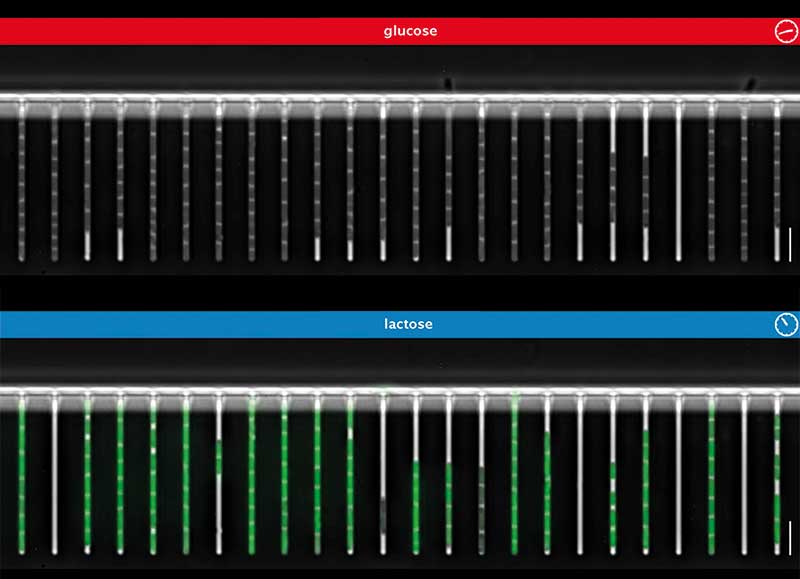
Ihr Plan sah vor, die Kohlenstoffquelle der Zellen von Glucose auf Lactose umzustellen, und die hierdurch ausgelösten Anpassungen in den einzelnen Zellen über mehrere Generationen hinweg mit der Zeitraffer-Mikroskopie zu beobachten. Dafür benötigten die Forscher jedoch eine Mother Machine, mit der sie zwei Medien in verschiedenen Mischungen durch den Hauptkanal leiten konnten. Um dies zu erreichen, versahen sie die Mother Machine mit zwei Medien-Einlässen, die sich in einem speziellen Ventil (Dial-a-Wave) vereinen. Über das Dial-a-Wave-Ventil, das zum Hauptkanal sowie zwei Abfall-Kanälen führt, werden die Medien gemischt und in den Hauptkanal geleitet.
Für die Genregulations-Experimente kultivierte die Gruppe in der modifizierten Mother Machine E.-coli-Zellen, die eine lacZ-GFP-Fusion beherbergten. Die Zellen wurden entweder kontinuierlich mit Glucose- beziehungsweise Lactose-Medium gefüttert, oder im vierstündigen Wechsel mit einem der beiden Medien. Mit einem Zeitraffer-Mikroskop, das alle drei Minuten ein Bild schoss, beobachtete das Team die einzelnen Zellen einen Tag lang und wertete die Aufnahmen mit einer eigens hierfür geschriebenen Software aus.
Die Ergebnisse, welche die Forscher aus Basel und Dresden mithilfe der Dual Input Mother Machine erhielten, waren teilweise überraschend. So stellten sie zum Beispiel fest, dass alle Zellen innerhalb von drei Minuten das Wachstum einstellten, wenn die Nährstoffversorgung von Glucose auf Lactose umgestellt wurde. Im Gegensatz zur Induktion des Lac-Operons, die komplett zufällig (stochastisch) abläuft, ist der hieraus resultierende Effekt auf das Wachstum der Zellen offensichtlich nicht vom Zufall abhängig und verläuft nach Plan (deterministisch).
Integrierte Zellisolierung
Äußerst raffiniert ist die Mother Machine, die das Team des Systembiologen Johan Paulsson von der Harvard Medical School in Boston Ende letzten Jahres vorstellte (Nat. Methods 17: 93-100). Mit ihr ist es nicht nur möglich, einzelne Zellen über längere Zeit mit der Zeitraffer-Mikroskopie zu beobachten und ihre Reaktionen auf Testsubstanzen zu verfolgen: Man kann mit ihr auch einzelne Zellen isolieren und nach erfolgter Phänotypisierung für weitere Experimente einsetzen, während die Kultivierung in der Mother Machine ungestört weiter läuft. Um die Mother Machine für diese sogenannte Single Cell Isolation Following Time-Lapse Microscopy-(SIFT)-Methode fit zu machen, statteten Paulssons Mitarbeiter sie mit einigen zusätzlichen Bauteilen aus. So legten sie zunächst parallel zum mediumführenden Hauptkanal einen Sammelkanal an, der ausgewählte Einzelzellen auffängt und zur Analyseeinheit weiterleitet. Die senkrecht zu Haupt- und Sammelkanal angeordneten Wachstumskanäle sind über eine Serie verschließbarer Ventile mit dem Sammelkanal verbunden. Zellen, die nicht isoliert werden sollen, gelangen am Ende des Wachstumskanals in den Hauptkanal und werden in diesem weitergeleitet. Soll die Zelle eingefangen werden, wird zunächst ein Ventil zum Sammelkanal geöffnet. Anschließend lenkt sie der Laserstrahl einer optischen Falle in den Sammelkanal, in dem sie zu einem sterilen Abschnitt auf dem Chip weitergeleitet wird.
Während der Zeitraffer-Mikroskopie sind Versorgungs- und Sammelkanal durch Ventile voneinander getrennt, die nur für das Einsammeln gezielter Zellen mit der optischen Falle geöffnet werden. Um Kontaminationen und Biofilme in den verschiedenen Kanälen der Mother Machine zu verhindern, werden die Ein- und Ausgänge des Sammel- und Hauptkanals regelmäßig mit einer Desinfektions-Lösung umspült. Entsprechende Ventile verhindern, dass die Mischung nicht in die Wachstumskanäle der Mother Machine gelangt.
Wie präzise man einzelne E. coli-Zellen mit dem SIFT-Verfahren verfolgen und isolieren kann, demonstrierten die Forscher mit Zellen, die ein gelbes (YFP), rotes (RFP) oder cyanfarbenes (CFP) Fluoreszenzprotein konstitutiv exprimierten.
Die farbmarkierten Zellen spülten sie im Verhältnis von eins zu hundert zusammen mit nicht-markierten E.-coli-Bakterien durch die Mother Machine. Dort besiedelten sie binnen 45 Minuten 95 Prozent der Wachstumskanäle und tauchten in diesen als Ketten von farblosen sowie rot, blau oder gelb fluoreszierenden Zellen auf. Die anschließend mit dem SIFT-Verfahren isolierten Zellen zeigten die erwarteten Fluoreszenzeigenschaften und waren frei von Kontaminationen.
Mit der SIFT-Methode lässt sich aber noch einiges mehr machen. Paulsson und seine Kollegen setzten sie zum Beispiel ein, um genetische Schaltkreise, sogenannte synthetische genetische Oszillatoren zu optimieren. Ein typisches Beispiel hierfür ist ein zweifach-rückgekoppelter Oszillator, bei dem negativ und positiv rückgekoppelte Transkriptions-Schleifen miteinander verbunden sind. Dies lässt sich zum Beispiel mit einem Promotor erreichen, der aus den aktivierenden Teilen des Arabinose-Promotors sowie den reprimierenden Teilen des LacZ-Promotors besteht.
Der gemischte Promotor wird durch das Protein AraC in Gegenwart von Arabinose aktiviert und gleichzeitig in Abwesenheit von IPTG durch das LacI-Protein reprimiert. Treibt man mit diesem gemischten Promotor die Transkription von AraC sowie LacI an, entsteht eine oszillierende positive und negative Rückkopplungsschleife.
Oszillierende Transkription
Die Periodizität der Oszillation lässt sich ganz einfach durch die Konzentration der Induktoren Arabinose sowie IPTG steuern. Fehlen diese, ist keine Oszillation zu beobachten – es sei denn, man mutiert einzelne Komponenten des genetischen Schaltkreises und erhält hierdurch einen Oszillator, der keinen zusätzlichen Induktor benötigt.
Paulssons Gruppe mutierte in den entsprechenden Promotoren und Operatoren alles, was nicht niet- und nagelfest war, um die Expression von AraC sowie LacI zu manipulieren. Die erhaltene Mutanten-Bibliothek mit etwa einer halben Million Varianten screente die Gruppe schließlich in Zeitraffer-Experimenten mithilfe der Mother Machine, wobei die Gruppe die E.-coli-Zellen über fünfzig Generationen verfolgte.
Die US-Forscher isolierten schließlich eine Mutante, die ohne zugesetzten Induktor mit einer erstaunlich exakten Frequenz oszillierte. Mit Paulssons Mother Machine lassen sich also auch sehr komplexe Phänotypen aufspüren und unter Myriaden von Zellen aussortieren.
Das Screening mit der SIFT-Mother Machine ist aber nicht nur auf Mikroorganismen beschränkt: Paulssons Gruppe geht davon aus, dass sie auch für das Durchmustern anderer Zellen geeignet ist, etwa Hefen oder nicht-adhärent wachsende Säugerzellen, wenn sie an diese adaptiert wird.
Letzte Änderungen: 09.02.2020