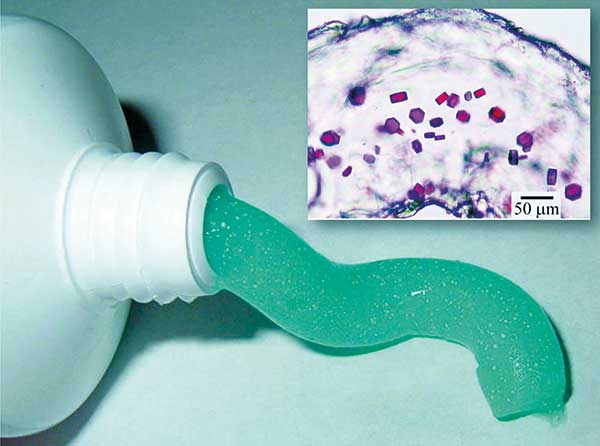
Proteinkristalle in Fettwürfeln
In-meso-Kristallisation
Andrea Pitzschke
Die dreidimensionale Struktur eines Proteins ist nicht nur für seine Funktion ausschlaggebend. Sie bestimmt auch, wo sich das Protein am liebsten aufhält, mit wem es interagiert und wie es auf ein bestimmtes Medikament reagiert. Zwar lässt sich mit bioinformatischen Algorithmen einiges zur Proteinstruktur vorhersagen, die harten Fakten liefert aber nur die Röntgenstrukturanalyse
.
Dafür muss das Kandidatenprotein aber zunächst als Einkristall mit einer anständigen Größe von mehr als einem halben Millimeter vorliegen. Bei der Kristallisation von Proteinen hilft ihr eingebauter Sinn für Ordnung. So komplex eine Proteinverbindung auch sein mag: Die einzelnen Proteinmoleküle, die kristallisieren sollen, sind strukturell identisch, haben die gleiche Ladungsverteilung und verfügen über gleiche hydrophobe oder hydrophile Abschnitte. Man kann sich das vorstellen wie einen Haufen extravaganter Designerschuhe mit Laschen, Schleifchen und anderem Schnickschnack. Immer dasselbe Modell, dieselbe Größe, alle rechts oder links. Will man die Schuhe in einem regelmäßigen Muster ordnen, muss man sie zu einem geordneten Haufen aufeinanderstapeln. Stapelt man zu hektisch, fällt der Haufen um und die mühsam hergestellte Ordnung ist passé.
Langsamer Prozess
Auch bei der Kristallisation von Proteinen ist Geduld gefragt. Sie werden keiner Schockbehandlung wie zum Beispiel beim Ausfällen mit Salzen unterworfen, sondern ganz allmählich aus der Lösung verdrängt. Nur so findet jedes Molekül seinen Platz in dem entstehenden periodischen Kristallverband. Die ersten Proteine finden sich zusammen und ordnen sich, dirigiert durch ihre Ladung sowie hydrophile oder hydrophobe Domänen, in einem Kristallisationskeim an. An diesen lagern sich sukzessive weitere Moleküle an, bis der Keim zu einem Protein-Einkristall heranwächst. Je nach Methode und Protein dauert dies mitunter Wochen oder sogar Monate. Besonders heikel ist die Kristallisation von Membranproteinen, die besondere Tricks verlangt. Bislang enthält die Proteindatenbank (www.wwpdb.org) Strukturinformationen zu etwa 360 Membranproteinen.
Die für die Strukturanalyse nötigen Einkristalle wurden meist mit der In-meso-Kristallisation hergestellt, die auf einem Lipid-Wasser-Gemisch beruht. Bei dieser Technik wird ein Lipid, meist Monoacylglycerol, mit Wasser vermengt, so dass sich beide spontan zu einer künstlichen Membran (Lipiddoppelschicht) formieren der sogenannten Lipidic Cubic Phase (LCP). Die LCP verhält sich wie eine flüssigkristalline Phase, die auch als Mesophase bezeichnet wird. Sie bietet Membranproteinen eine nahezu native Umgebung, in der diese eingebaut beziehungsweise rekonstituiert werden. Gibt man zusätzliche Fällungsmittel (Precipitants) hinzu, bilden die Membranproteine in der Mesophase Kristallisationskeime und wachsen schließlich zu Einkristallen heran.
Die LCP ist von winzigen Wasserkanälen durchzogen. Wie behandschuhte Finger beim Händedruck greifen diese Wasserkanäle, die einen Durchmesser von drei bis fünf Nanometer aufweisen, ineinander. Aufgrund der Lipidhüllen, die sie umgeben, sind sie jedoch nicht in direktem Kontakt. Diesen Zustand nennt man Bicontinuous Cubic Phase. Bicontinuous, weil sich wässrige Phase und Lipiddoppelschicht kontinuierlich dreidimensional ausdehnen. Die viskose und zähe Konsistenz der kubischen Phase ähnelt Zahnpasta. Und wie in manchen Zahnpastas kleine weiße Kristalle eingelagert sind, wachsen in der LCP-Mesophase Proteinkristalle.
Die LCP-Mesophase lässt sich mit sehr einfachen Mitteln herstellen und mit dem gewünschten Protein für die Kristallisation befüllen. Hierzu verbindet man zwei Hamilton-Spritzen über eine Kupplung miteinander. Eine Spritze enthält das Lipid, die andere die Proteinlösung. Pipettiert man die beiden Lösungen in den Spritzen hin und her, entsteht eine mit Protein gefüllte Mesophase. Das Protein wird in die „Zahnpasta“ beziehungsweise Mesophase eingelagert und kristallisiert schließlich „in-meso“. Diese simple Technik funktioniert jedoch nicht immer. Meist sieht man aber bereits aus den in silico erhaltenen Daten, welche Proteine bei der Kristallisation Ärger bereiten könnten.
Bei der traditionellen In-meso-Kristallisation können die Anteile von Wasser und Lipid in der LCP nicht beliebig gewählt werden. Bildhaft ausgedrückt fehlen hierdurch für dicke Finger, beziehungsweise Wasserkanäle mit größeren Durchmessern, die passenden Handschuhe (Lipidhüllen). Membranproteine mit ausgedehnten extrazellulären, hydrophilen Domänen benötigen jedoch breitere Kanäle, um zu kristallisieren.
Aber wie kann man die LCP-Mesophase aufweiten, ohne sie zum Platzen zu bringen?
In Einzelfällen gelang dies durch Zusatzstoffe wie Zuckerester und diverse Phospholipide. Besonders vielversprechend ist das elektrostatische Dehnen mittels anionischer Phospholipide. Mit dieser Technik lässt sich der Wassergehalt in Mesophasen von 40 auf 70 Prozent erhöhen. Diese Soufflee-artigen Systeme müssen jedoch stabilisiert werden, wozu häufig Cholesterin eingesetzt wird. Cholesterin kann das Soufflee zwar stabilisieren, wirkt aber erst so richtig bei Temperaturen von 35 bis 45°C. Das ist vielen Proteinen schon deutlich zu warm, und überhaupt ist die Proteinkristallisation ein Prozess, der vorzugsweise bei niedrigen Temperaturen funktioniert.
Angeschwollene Mesophase
Aus diesem Grund gelang es bisher nicht, Membranproteine mit der In-meso-Technik zu kristallisieren, die große extrazelluläre Domänen (ECDs) enthalten. Abhilfe schaffen hier die sogenannten stark angeschwollenen Lipid-Mesophasen (ultra-swollen lipidic mesophases), die ein Team um Raffaele Mezzenga vom Laboratory of Food and Soft Materials der ETH Zürich entwickelte (Nat commun: 544).
Ausgangspunkt der Schweizer In-meso-Kristallisation ist eine neue Mischung für die LCP. Statt des bisher üblichen Mono-Oleins als Lipidkomponente verwendete das Team Monopalmitolein (MP). Dieses hat einen kürzeren hydrophoben Schwanz (C16- statt C18-kettige Monoacylglycerole) und kann mehr Wasser aufnehmen – beides Wohlfühlbedingungen für hydrophile Membranproteine. In Kombination mit dem Lipid DSPG (1,2-Distearoyl-sn-glycero-3-phospho-rac-glycerol; Natriumsalz), das für das elektrostatische Anschwellen sorgt, erhielten Mezzengas Mitarbeiter aufgeblähte Mesophasen mit bis zu 80 Prozent Wasseranteil. Diese waren bei 20°C stabil.
Mit der SAXS (Synchroton Small-angle X-ray Scattering)-Analyse nahm das Team die künstlichen Membranen unter die Lupe und fand Wasserkanäle, die bis zu fünfmal dicker waren als in traditionellen Mesophasen. Je nach DSPG-Konzentration (3%, 5%, 8%) sowie dem Lipid-zu-Wasser-Verhältnis, variierte die Symmetrie der entstandenen LCP zwischen den Raumgruppen Im3m, Pn3m sowie Ia3d des kubischen Kristall-Systems.
Wechselnde Symmetrie
Wie die Umwandlung der Mesophase in unterschiedliche Symmetrieformen vor sich geht, ist Raffaele Mezzenga noch nicht ganz klar: „Es handelt sich hierbei um ‚statische‘ Änderungen zwischen unterschiedlichen Mesophasen. Statisch, da das Phasendiagramm per Definition Messdaten im Zustand des thermodynamischen Gleichgewichts sammelt. Die wohl faszinierendste Eigenschaft ist das systematische Wiedereintreten unterschiedlicher Symmetrien der Bicontinuous Cubic Phase nach der Wasserzugabe. Dieses Phänomen verstehen wir noch nicht ganz.“
Auf die Frage, wie dick die „Finger“ respektive die Membranproteine sein dürfen, meint Mezzenga, dass die Ultra-swollen-Mesophase die Kristallisation sämtlicher Membranprotein-Typen ermöglichen sollte. Sie müsste selbst bei Membranproteinen mit zwanzig Nanometer großen intra- oder extrazellulären Domänen funktionieren.
Zur Präparation der angeschwollenen Mesophase löst man zunächst eingewogene Mengen der Lipide MP und DSPG in Chloroform auf und mischt sie im gewünschten Verhältnis. Im Rotationsverdampfer verflüchtigt sich das Chloroform anschließend wieder. Das getrocknete MP/DSPG-Gemisch wird anschließend in Wasser gegeben. Je nach gewünschter Hydratisierung macht das Wasser 40 bis 80 Prozent des Gewichtsanteils aus. Mit einem Vortexer wird das Ganze zu einer homogenen Flüssigkeit verwirbelt, die anschließend drei Tage ruhen muss. Danach ist die Ultra-swollen lipidic Mesophase äquilibriert und einsatzbereit. Das rekombinante, über Affinitäts-Tag und Ionenaustausch-Chromatographie gereinigte Protein wird mit der vorbereiteten Mesophase im Verhältnis von 80 zu 20 vermischt und in 200-Nanoliter-Portionen auf eine Glasoberfläche getropft.
Ähnlich wie bei der „quetschfreien Mikroskopie“ fragiler Gewebe liegt um den Tropfen herum ein Spacer-Rahmen aus doppelseitigem Klebeband. Anstelle eines Deckgläschens kommt ein hauchdünner Plastikfilm obenauf. Für das exakte Pipettieren und den wackelfreien Zusammenbau sorgt ein Roboter. Anschließend heißt es warten und Daumen drücken, dass die Kristallisation klappt.
Praxistest bestanden
Wie gut die geschwollene Mesophase bei der Kristallisation von Proteinen mit großen extrazellulären Domänen funktioniert, demonstrierte die Gruppe anhand des E. coli-Virulenzfaktors Intimin, sowie des Gloeobacter Ligand-Gated Ion Channel (GLIC)-Proteins. Intimin ist ein Membranprotein mit moderat langer ECD, das bereits mit traditionellen Mesophase-Systemen kristallisiert wurde. GLIC ist ein 174 kDa großes Membranprotein mit einer ziemlich imposanten extrazellulären Domäne.
Die Kristallisation von Intimin gelang der Gruppe wie erwartet problemlos. Bei GLIC dauerte sie, je nach DSPG-Anteil im Mesophasensystem, sieben bis zehn Tage. Die anschließende Strukturanalyse der Proteinkristalle mittels Kleinwinkel-Röntgenstreuung (Small-angle X-ray-Scattering) ergab eine Auflösung von sechs Angström.
Zu klein sollte der gewachsene Einkristall für die Strukturanalyse nicht sein, erklärt Mezzenga: „Je größer der Kristall, desto leichter lässt er sich angeln und im Teilchenbeschleuniger zur Strukturbestimmung mit Röntgenstrahlen beschießen. Größere Kristalle zeigen in der Regel eine bessere Röntgenbeugung, die zu einer höheren Auflösung führt. Die Größe der wachsenden Kristalle lässt sich während des In-meso-Kristallisationsprozesses über Polarisationsmikroskopie messen.“
Hat man die Membranprotein-Kristalle erst einmal in den Händen, ist das Gröbste überstanden. „Wenn man die Kristalle kühl lagert, wie das bei der Proteinkristallisation normalerweise der Fall ist, können sie problemlos transportiert werden“, beruhigt Mezzenga.
Wäre auch zu schade, wenn die mühevoll mit der geschwollenen In-meso-Kristallisation gewonnen Proteinkristalle auf dem Weg zur Strukturanalyse noch auseinanderfallen würden. Zu sicher sollte man sich beim Umgang mit Membranprotein-Kristallen aber nie sein.
Letzte Änderungen: 08.05.2018