Melanopsin
von Petra Stöcker (Laborjournal-Ausgabe 4, 2005)
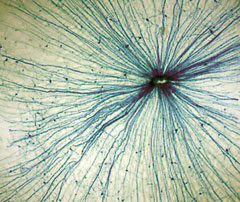
Wie ein Spinnennetz ziehen sich Melanopsin-produzierende Ganglienzellen über die Netzhaut.
Wach werden ohne Weckergebimmel - dafür sorgt irgendwann unsere innere Uhr. Der circadiane Rhythmus, den sie uns vorgibt, unterliegt dabei unter anderem den unterschiedlichen Lichtverhältnissen unserer Umgebung, wie etwa dem Tag-und-Nachtwechsel oder unterschiedlichen Tageslichtlängen im Verlauf der Jahreszeiten.
Lange Zeit jedoch war unklar, wie und womit Säugetiere diese Lichtreize wahrnehmen. Denn die Auswahl an dafür in Frage kommenden Sehzellen in der Netzhaut ist nicht gerade berauschend: da wären zum einen die Zapfen, die in drei unterschiedlichen Klassen verantwortlich für das Farbsehen sind; und zum anderen die Stäbchen, die Licht unterschiedlicher Wellenlänge auch bei geringer Helligkeit wie etwa Mondlicht wahrnehmen (Dämmerungssehen) und bei hoher Leuchtdichte (Sonnenlicht) inaktiv werden. Alles aber nicht sonderlich überzeugend, denn auch blinde Versuchstiere, denen diese Rhodopsin-haltigen Stäbchen und Zapfen fehlen, zeigen eine gesunde Tagesrhythmik.
Spinnweben in der Netzhaut
Im Jahre 2002 beschrieb indes der Neurowissenschaftler David Berson mit seinem Team von der Brown University, Rhode Island, eine neue Klasse spinnwebartig angeordneter Zellen in der Retina mit dem klangvollen Namen "intrinsically photosensitive retinal ganglion cells", kurz "ipRGCs" (Science 295, S.1065). Diese speziellen Ganglienzellen reagieren auf Helligkeitsunterschiede und besitzen einen direkten Draht zum suprachiasmatischen Nukleus (SCN), der als stecknadelkopfgroßer Nervenkern im Hypothalamus den 24 Stunden-Takt koordiniert. In diesen lichtempfindlichen Zellen entdeckten die US-Forscher zudem das Protein Melanopsin, welches bereits aus der Haut von Fröschen bekannt war, die ihre Hautfarbe der Umgebung anpassen können.
Klares Indiz, um das Molekül genauer ins Visier zu nehmen. Wie der Name schon vermuten lässt, gehört es wie das Photopigment Rhodopsin zur Gruppe der Opsine, ist also ein Membranprotein mit sieben transmembranen alpha-Helices, dessen Signalübertragung an G-Proteine gekoppelt ist. Gleich vier Forscherteams haben nun Schlag auf Schlag unabhängig voneinander Nachweise liefern können, dass die Ganglienzellen ihre Lichtempfindlichkeit in der Tat dem Melanopsin verdanken.
Vier auf einen Streich
Drei der Veröffentlichungen sind "back to back" in ein und derselben Ausgabe von Nature zu finden (Bd. 433). Auf den Seiten 741-745 beschreibt eine Gruppe um Mark Hankins vom Department of Visual Neuroscience des Imperial College in London heterologe Expressionsversuche mit humanem Melanopsin in einer Maus-Nervenzelllinie (Neuro-2a). Ähnliches zeigt auf den folgenden Seiten (S. 745-749) Bersons Gruppe mit speziellen HEK293-Zellen. Paul Gamlin und seine Mitarbeiter der University of Washington präsentieren schließlich ihre Erkenntnisse aus Untersuchungen an Primatenretina (S. 749-754). Der vierte im Bunde, Thomas Jegla vom Genomic Institute der Novartis Research Foundation in San Diego exprimierte Melanopsin in Xenopus-Eizellen und landete mit seinen Ergebnissen in Science (Bd. 307, S. 600).
So vielfältig die Experimente, so einheitlich ihre Ergebnisse: Zellen, die normalerweise lichtunempfindlich sind reagieren durch das untergeschobene neue Protein ähnlich photosensitiv wie die Melanopsin-haltigen ipRGCs. Bei Lichteinfall beobachteten die Teams an ihren Zellkulturen eine Depolarisation der Zellmembran sowie erhöhte intrazelluläre Calciumspiegel; am effektivsten waren Wellenlängen von etwa 479 nm.
Wie bei Wirbellosen
Hier jedoch unterscheidet sich die Lichtreaktion von denjenigen der Stäbchen und Zapfen: während bei jenen der Lichtreiz zu einer Hemmung der elektrischen Aktivität der Zelle führt, erhöht er sie im Falle von Melanopsin. Damit verhält sich Melanopsin ähnlich den Opsinen, wie sie etwa bei Insekten vorkommen.
Die Signalübertragung funktioniert über Gq oder ein verwandtes G-Protein, Retinaldehyd, Phospholipase C und TRPC3 (transient receptor potential)-Kanäle. Auch hier sind sich die Gruppen einig, dass die durch Melanopsin in Fahrt gebrachte Signalkaskade in Säugerzellen sehr derjenigen bei Wirbellosen ähnelt. Beispielsweise ist der aktivierte Kationen-Kanal TRPC3 homolog zu den photoaktiven Kanälen TRP und TRPL aus Drosophila. Wieder einmal ist man hier wohl einem uralt-bewährten System auf der Spur.
Auch die Gegenprobe mit Knockout-Mäusen bestätigt die bisherigen Ergebnisse. Tiere, denen das Melanopsin-kodierende Gen Opn4 fehlt, können sich wesentlich schlechter einem 24-stündigen Tagesrhythmus mit wechselnden Lichtverhältnissen anpassen.
Visionen mit Lichtsensoren
Kaum in der Grundlagenforschung entdeckt und da noch in den Kinderschuhen, schmiedet man schon erste Zukunftspläne für das frisch identifizierte Photopigment. Die Ideen für den praktischen Einsatz reichen von der Behandlung des Jetlags und bestimmter Schlafstörungen bis hin zu speziellen Formen der Depression. Forscher am Imperial College in London gehen sogar soweit, eine Art künstliche Retina-Prothese zu entwickeln. Mittels Melanopsin sollen "normale" Netzhautzellen zu Lichtsensoren umfunktioniert werden, damit bestimmte erblindete Patienten ein rudimentäres Sehvermögen zurückgewinnen können.
Möglich jedoch, dass an der "Zeitschaltuhr" im Gehirn noch weitere Moleküle beteiligt sind. Wenn auch Melanopsin offenbar das wichtigste zu sein scheint. Dennoch sollte man sich für frühmorgendlich angesetzte Experimente nicht nur auf sein Melanopsin verlassen. Der altbewährte Weckeralarm wird wohl weiterhin nötig bleiben.
Letzte Änderungen: 10.05.2005