Unkompliziert zum
rekombinanten Protein
(19.01.2022) E. colis wachsen nicht nur in Flüssigkulturen, sondern auch auf einer feucht gehaltenen Membran. Auf dieser sind sie sogar noch produktiver.
Die rekombinante Proteinproduktion in E. coli verlangt vor allem eines: perfektes Timing. Zunächst müssen sich die Bakterien in Flüssigkulturen ordentlich vermehren. Dann folgt der eigentliche Startschuss für die rekombinante Proteinexpression, etwa durch Zugabe von IPTG als künstlichen Induktor für das LacOperon. Würde schon die Kultivierung unter induzierenden Bedingungen ablaufen, stünden die Zellen vor einem Interessenskonflikt, der die Ausbeute dämpft, denn sie können sich nicht gleichzeitig auf hochtourige Zellteilung und kräftige Proteinexpression einstellen. Abgesehen davon sollten Zellen nicht länger als nötig mit IPTG konfrontiert sein, da dieses auch toxisch wirken kann.
Wenn sich die Zelldichte dem Optimalwert nähert, der meist bei einer optischen Dichte (OD) von etwa 0,8 erreicht ist, beginnt das nervöse Hin und Her zwischen Photometer und Kolbenschüttler. Jede Unterbrechung des Schüttelns bedeutet eine suboptimale Sauerstoffversorgung, welche die Bakterien prompt mit Expressions- und Vitalitätseinbußen quittieren.
Alternative gesucht
Yoshiro Hanyu vom National Institute of Advanced Industrial Science and Technology in Tsukuba, Japan, und sein Kollege Mieko Kato vom japanischen Start-up Bio-Peak sahen sich daher nach einer brauchbaren Alternative zu klassischen Flüssigkulturen um. Im Visier der beiden Japaner waren insbesondere rekombinante Antikörper, genauer gesagt variable Einzelketten-Fragmente (scFv). Durch ihre kleine Größe, ihr schnelles Eindringen in Gewebe sowie ihre geringe Immunogenität sind scFv insbesondere für Library-Screenings attraktiv.
Um scFv möglichst effektiv in E. coli exprimieren zu können, mussten Hanyu und Kato ein System finden, mit dem sie die Sauerstoff- und Nährstoffversorgung kontinuierlich gewährleisten konnten. Darüber hinaus benötigten sie einen internen Sensor für den Start der Expression sowie eine Technik, mit der sie die Zellen möglichst einfach ernten und die rekombinanten Proteine mit guten Ausbeuten aus diesen extrahieren konnten.
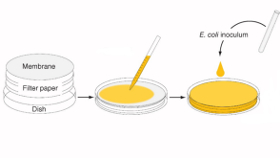
Die praktische Lösung für diese Vorgaben ist erfreulich unkompliziert: die E.-coli-Zellen werden einfach auf einer feuchten Membran kultiviert. Dazu befüllt man eine Neun-Millimeter-Petrischale mit zwanzig Millilitern TB-Medium, legt ein Filterpapier hinein und platziert auf dem Papier eine hydrophile Nylonmembran (siehe Bild). Die Zellen aus einer herkömmlichen Vorkultur werden in 100 Mikroliter Autoinduktionsmedium (LB, 0,05 % Glucose, 0,1 % Laktose) aufgenommen und auf der Membran verteilt. Der Flüssigkeitspegel ist einerseits hoch genug, um die Zellen vor der Dehydrierung zu bewahren, andererseits so niedrig, dass sie nicht darin „absaufen“ und an Sauerstoffmangel zugrunde gehen.
Selbstbestimmte Bakterien
Die Nährstoffversorgung durch Filter und Membran ist besser als bei der Kultivierung auf Agar. Zudem ist aufgrund des Autoinduktionsmediums kein IPTG nötig, denn die Zellen bestimmen selbst, wann die Produktionsphase startet. Die Mixtur zur Autoinduktion hatten die beiden Japaner schon 2019 verwendet, wenn auch mit anderen Membranen (Biotechniques, 66(4): 194–197).
Die darin enthaltene Glukose inhibiert das LacOperon und damit die rekombinante Proteinexpression. Diese Hemmung weicht allmählich einer Aktivierung. Zuerst futtern die wachsenden Zellen die Glukose weg. Danach ist die Laktose dran, die teilweise zu Allolaktose umgewandelt wird. Allolaktose induziert schließlich anstelle von IPTG das Operon, woraufhin die scFv exprimiert werden. Mithilfe einer Signalpeptid-Fusion landen die Antikörper vornehmlich im periplasmischen Raum, aus dem sie wesentlich leichter zu isolieren sind als aus dem Bakterieninneren. Hierzu müssen die Zellen nur von der Membran geschabt, in PBS gelöst und mit einem kalten osmotischen Schock zerlegt werden. Über Nickel-Säulen werden die His-getaggten Proteine schließlich isoliert.
Dreimal höhere Ausbeute
Hanyu und Kato verglichen ihre Methode mit der klassischen IPTG-induzierten Schüttel-Flüssigkultur und produzierten unter anderem anti-Kaninchen IgG scFv sowie anti-Human IgG scFv. In beiden Fällen ging es mit dem gleichen Inokulum los. Die Zahl der Zellen nach einem Tag war jeweils ähnlich. Mit der Membran-Methode war die Ausbeute an scFv jedoch zwei- bis dreimal höher.
Dafür könnten verschiedene Gründe verantwortlich sein: eine stärkere Expression, ein besserer Abtransport der Proteine in das Periplasma oder ein geringerer Verlust durch Einschlusskörper. Der wahren Ursache sind die Japaner noch auf der Spur. Sie fassen aber bereits höher skalierte Membran-Kulturen ins Auge, etwa mithilfe größerer Membranen, alternativen Membran-Materialien sowie exakt an die Bakterien angepassten Medien und Temperaturen.
Andrea Pitzschke
Hanyu Y. & Kato M. (2021): High-yield expression of periplasmic single-chain variable fragments by solid Escherichia coli. BioTechniques, 72: 29–32
cultures
Bild: Hanyu Y. et al.