Energietransfer verrät Virus
(26.05.2021) Mit FRET-Assays lassen sich nicht nur Protein-Protein-Interaktionen untersuchen, sondern auch SARS-CoV-2 Antigene nachweisen.
Beim Fluoreszenz- beziehungsweise Förster-Resonanzenergietransfer (FRET) überträgt ein angeregtes Donor-Fluorophor Energie auf ein nur wenige dutzend Ångström entferntes Akzeptor-Fluorophor, wodurch Letzteres fluoresziert. Verwendet man langlebige Lanthanoid-Fluorophore als Donor, wie etwa Europium, kann man mit der zeitaufgelösten FRET (TR-FRET) Anregung und Emission von Donor- und Akzeptor-Fluorphor nach Abklingen der kurzlebigen Hintergrundfluoreszenz messen.
Jussi Hepojoki und seine Kollegen von der Universität Helsinki entwickelten in den letzten Jahren schon verschiedene Immunoassays zur Antikörper-Detektion, die auf dem zeitaufgelösten Förster-Resonanzenergietransfer basieren. Die Technik funktioniert aber genauso auch für den Nachweis von Antigenen, wie die Finnen am Beispiel eines SARS-CoV-2-Nachweises demonstrieren.
Brücke für Transfer
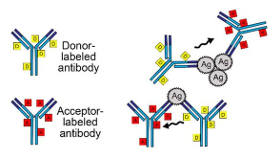
Das Prinzip besteht darin, ein nachzuweisendes Antigen als Brücke zu verwenden (siehe Abbildung), das Donor- und Akzeptor-Fluorophor so nahe zusammenführt, dass der Energietransfer stattfinden kann. Das ist zum Beispiel dann der Fall, wenn zwei markierte Antikörper an unterschiedliche Regionen des selben Antigens binden - oder sich zwei Antigene einander nähern, an denen mit Donor- beziehungsweise Akzeptor-Fluorophor markierte Antikörper anhaften.
Für den TR-FRET-Assay von SARS-CoV-2 markierte die Gruppe polyklonale Antikörper gegen das Nukleoprotein (NP) sowie gegen die Rezeptorbindedomäne (RBD) des Spike-Proteins von SARS-CoV-2 mit Europium (Donor) sowie Alexa Fluor 647 (Akzeptor). Um die Pufferbedingungen und Konzentrationen zu optimieren, verwendeten die Finnen zunächst rekombinante RBD- und NP-Antigene sowie Viren aus Zellkultur-Überständen. Am geeignetsten erwies sich ein mit BSA versetzter sogenannter RIPA-Puffer, der meist in Radioimmuno-Präzipitations-Assays eingesetzt wird. Die darin enthaltenen Detergenzien (1% NP-40 und 0,1% SDS) zerstören die Hülle von Viren und machen sie hierdurch unschädlich.
Für Hochdurchsatz geeignet
Die finnische Gruppe erzielte maximale FRET-Signale, wenn sie rekombinante Antigene und die dazugehörigen Antikörper in equimolarer Konzentration verwendete. Der optimierte Reaktionsansatz enthält 10 Mikroliter Antikörperlösung (24 nM, aus gleichen Teilen Eu- und AF 647-markierter Antikörper), die mit 10 Mikroliter Probenlösung eines Nasenraum-Abstrichs gemischt wird. Die Fluoreszenzmessung (Donor bei 616 nm, Akzeptor bei 656 nm) in einem Plattenlesegerät erfolgt fünf bis sechzig Minuten nach dem Mischen.
Der SARS-CoV-2-Test mit der TR-FRET-Technik ist zwar nicht so leicht auszuführen, wie ein einfacher Antigen-Schnelltest und erfordert entsprechende Geräte. Dafür ist er aber auch für den Hochdurchsatz geeignet und kann beispielsweise in 384-Well-Platten durchgeführt werden. Bei Analysen von Patienten-Abstrichen konnten die Finnen mit dem TR-FRET-Test SARS-CoV-2-Antigene in Proben nachweisen, die in qPCR-Tests einen Schwellenwertzyklus (Ct) von unter 25 aufwiesen. Damit war er deutlich sensitiver als ein zum Vergleich ausgeführter Immunoblot.
Andrea Pitzschke
Rusanen J. et al. (2021): A generic, scalable, and rapid Time-Resolved Förster Resonance Energy Transfer-based assay for antigen detection SARS-CoV-2 as a Proof of Concept. Mbio, 12(3):e00902-21
Bild: Rusanen et al.