Algorithmus detektiert
Metastasen
(18.12.2019) Die manuelle Annotation von Metastasen in Mäusen kann Monate dauern. Ein neuer Bildanalyse-Algorithmus schafft es in wenigen Stunden.
Krebs ist heimtückisch. Selbst wenn sich ein Tumor nach einer Therapie vermeintlich geschlagen gibt, können sich bereits hunderte Tumorzellen als Metastasen wie tickende Zeitbomben über den ganzen Körper verstreut haben. Um sie rechtzeitig zu erkennen, ist ein geschultes Auge nötig. Und viel Zeit. Selbst Experten können nur eine begrenzte Anzahl Bilder nach potenziellen Metastasen absuchen – und der Zeitdruck führt unweigerlich zu Fehlern.
Automatische Bildanalyse-Verfahren sind zwar schneller, aber noch sehr unzuverlässig. Ein großes Team um Ali Ertürk und Reinhard Zeidler vom Helmholtz Zentrum München sowie Bjoern Menze von der Technischen Universität München entwickelte daher eine Imaging-Technik, die winzige Metastasen und sogar einzelne Tumorzellen, in ganzen Mauskörpern zuverlässig und schnell detektiert. Das Münchner Erfolgsrezept beruht auf der Bildaufnahme mit der sogenannten vDISCO-Technik und einem effizienten Deep-Learning-Algorithmus (deepMACT) für die Bild-Auswertung.
vDISCO lüftet den Schleier
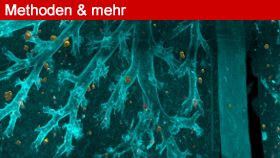
Gängige Verfahren zur Metastasen-Detektion in Modelltieren machen sich Fluoreszenz-Proteine wie zum Beispiel mCherry oder Luciferase zunutze, die von transgenen Krebszellen exprimiert werden. Das Problem dabei: Die Autofluoreszenz des Mausgewebes kann auf eine falsche Fährte führen oder Metastasen verschleiern. Ein sauberer Hintergrund und stärkeres Leuchten der Krebszellen würde das Problem lösen. Mit der von Ertürk und seinen Kollegen ausgetüftelten Ganzkörper-Immunolabelling-Technik vDISCO ist dies möglich (Nat Neurosci, 22(2):317–32).
Die Maus wird für vDISCO mit Paraformaldehyd (PFA) perfundiert und hierdurch fixiert. Der Körper bleibt intakt und ist durchsichtig genug für einen Ganzkörper-Scan mit einem Lichtscheiben-Mikroskop. Um das Fluoreszenz-Signal in den transparenten Mäusen zu verstärken, werden Fluoreszenz-markierte Nanobodies injiziert, die an die exprimierten Fluoreszenz-Proteine binden. Wie die einzelnen Schritte des vDISCO-Verfahrens im Detail funktionieren, erklärt die Gruppe auf der Webseite www.discotechnologies.org.
Fluoreszierende Leuchtinseln
vDisco erhöht das Fluoreszenz-Signal um das Hundertfache. Während in Mäusen mit Fluoreszenz-gelabelten Krebszellen nur wenige, größere Metastasen sichtbar sind, erscheinen in den gleichen Mäusen, nach PFA-Perfusion und Nanobody-Detektion, viele zusätzliche kleine Leuchtinseln. Alle stellen potenzielle Metastasen dar, könnten aber auch Artefakte sein.
Um die Metastasen zuverlässig und automatisch detektieren zu können, entwickelten die Bildverarbeitungs-Spezialisten der Gruppe um Bjoern Menze die Software DeepMACT (Deep learning based Metastasis Analysis in Cleared Tissue), die auf einem gefalteten neuronalen Netzwerk (CNN; Convolutional Neuronal Network) sowie einem Deep-Learning-Algorithmus basiert.
Das DeepMACT-Programm wird mit den Daten von gesunden oder metastasierenden Mäusen gefüttert, die mit einem Lichtscheiben-Mikroskop gescannt wurden. Das Programm lernt hierdurch Signale zu unterscheiden, die von Metastasen oder von Hintergrundsignalen ausgehen. Die Bilder werden aus drei Projektions-Ebenen analysiert (x-, y- oder z-Ausrichtung). Der Algorithmus sammelt Informationen über die Umgebung jedes zweidimensionalen Pixelpunktes und rekonstruiert hieraus ein dreidimensionales Volumensegment. Durch das Training kann er immer besser abstrahieren und lernt, unterschiedlich geformte sowie kleine und große Metastasen zu erkennen.
Da aus der zunächst großen Datenmenge nur die relevanten Informationen zur Weiterverarbeitung in die nächste Stufe übernommen werden, reduziert sich der Rechenaufwand erheblich. Was ein erfahrener Onkologe in einem Monat schafft, erledigt das DeepMACT-Programm in wenigen Minuten – und arbeitet dabei genauso exakt wie der Experte.
Zuverlässig identifiziert
Das Münchner Team testete DeepMACT in fünf metastasierenden Krebsmodellen, unter anderem Brust-, Lungen-, und Bauchspeicheldrüsenkrebs. Das Programm identifizierte bei diesen Experimenten zuverlässig Metastasen verschiedener Größe, Form sowie räumlicher Verteilung.
Darüber hinaus ging die Gruppe der Frage nach, wie effektiv therapeutische Antikörper bei personalisierten Krebs-Behandlungen wirken. Dazu verglich sie die Fluoreszenz-Signale von Krebszellen mit den Signalen eines gegen die Krebszellen gerichteten therapeutischen Antikörpers.
Die Ergebnisse sind ernüchternd. Etwa 23 Prozent der Mikrometastasen „übersah“ der Antikörper. Etwas besser schnitt er in der Lunge ab. Hier erkannte er 15 Prozent der Metastasen nicht, im restlichen Körper waren es dagegen 44 Prozent. Die Nähe zu Blutgefäßen scheint für die Trefferquote relativ unbedeutend zu sein. Wichtiger sind dagegen (unbekannte) Faktoren in unmittelbarer Umgebung einer Krebszelle. So lagen die von dem therapeutischen Antikörper aufgespürten Metastasen jeweils näher beieinander, als nicht-erkannte Metastasen.
Andrea Pitzschke
Pan C. et al. (2019): Deep Learning reveals cancer metastasis and therapeutic antibody targeting in the entire body. Cell, 179 (7): 1661-76.e19
Illustr.: Helmholtz Zentrum München