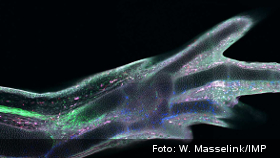
Neue Beine für den Axolotl
(23.10.2018) Salamander sind die einzigen Vierbeiner, denen verloren gegangene Gliedmaßen nachwachsen. Stammzellen brauchen sie dafür jedoch nicht.
Wäre es nicht ein Segen, wenn uns Arme oder Beine, die wir durch Unfall oder Krankheit verloren haben, innerhalb von ein paar Tagen bis Wochen wieder nachwachsen würden? Was sogenannte „niedere“ Tiere wie Regenwürmer können, ist uns hoch entwickelten Wirbeltieren nicht mehr möglich. Keinem von uns? Doch, denn eine kleine Gruppe von Amphibien, die Salamander, sind sehr wohl in der Lage, Gliedmaßen und teilweise sogar innere Organe bei Verlust nachzubilden.
Einer der wohl bekanntesten Salamander ist der mexikanische Axolotl (Ambystoma mexicanum). Weltweit leben in Aquarien mehr Individuen dieses Querzahnmolchs als in freier Wildbahn, wo sie durch eine Einschränkung ihres natürlichen Lebensraumes inzwischen vom Aussterben bedroht sind. Einen ungewöhnlichen Anblick bietet der Axolotl durch seine gut sichtbaren Kiemenbüschel, die zeitlebens erhalten bleiben. Normalerweise wandeln sich Amphibien in der Metamorphose von der wasserlebenden Larve zum landlebenden Adulttier – Rückbildung der Kiemen inklusive. Der Axolotl macht jedoch aufgrund fehlender Schilddrüsenhormone keine Metamorphose durch und wird als Larve geschlechtsreif. Ein solches Leben als Dauerlarve bezeichnet man als Neotenie.
„Riesenbabys“ mit Neigung zum Kannibalismus
Mindestens genauso aufregend, aber nach außen weniger auffällig, ist die außergewöhnliche Regenerationsfähigkeit der Querzahnmolche. Vermutlich war sie ein Überlebensvorteil für die kannibalisch veranlagten Tiere, die durch Artgenossen schnell mal ein Bein verlieren können. Die Regenerationsfähigkeit ist auch ein Grund, warum der Axolotl so schnell zu einem Modellorganismus in der Biomedizin aufgestiegen ist. Wenn wir verstehen, wie der Axolotl Körperteile nachbildet, können wir diese Erkenntnisse vielleicht auf andere Wirbeltiere – und damit auf uns – übertragen. Der Traum vom neuen Arm oder Bein rückt damit in greifbare Nähe.
Leider war es bisher gar nicht so einfach nachzuvollziehen, wie nach einer Verletzung ein neues Bein entsteht. An der verletzten Stelle bildet sich zuerst ein Blastem aus multipotenten Zellen, das innerhalb von wenigen Wochen ein funktionsfähiges neues Bein mit all seinen verschiedenen Gewebetypen wie Muskeln, Nerven und Bindegewebe hervorbringt. Aber woher stammen die Blastem-Zellen? Gibt es in gesundem Gewebe bereits eine Population dieser multipotenten Zellen, die nach einer Verletzung die Regeneration antreibt? Und gleichen die Blastem-Zellen eigentlich den undifferenzierten Zellen, die in einer embryonalen Gliedmaßen-Knospe vorliegen?
Einem Forscher-Team aus Wien, Leipzig und Dresden ist es nun gelungen, den Weg einer Blastem-Vorläuferzelle nach dem Verlust eines Beins nachzuverfolgen. Dabei zeigte sich, dass entgegen früherer Vermutungen kein Pool von stammzellartigen Zellen existiert, die in einen Beinstumpf einwandern. Schon einfache Berechnungen legten dies nahe, denn das reife Bindegewebe müsste zu mindestens 20 Prozent aus multipotenten Zellen bestehen, damit daraus im Bedarfsfall ein neues Bein entstehen könnte – ein ziemlich unrealistisches Szenario! Dazu passte, dass im unverletzten Gewebe verschiedene Bindegewebs-Zelltypen mit unterschiedlichen Zellmarkern und Transkriptions-Profilen nachweisbar waren, darunter aber keine Zellen mit Markern für Blastem-Zellen.
Zurück auf Null
Stattdessen waren es ausdifferenzierte Bindegewebs-Zellen, die sich nach einer Verletzung in einen undifferenzierten, multipotenten Zustand zurückentwickelten. Dabei nahm die Heterogenität im Gewebe deutlich ab; die Zellen wurden sich sowohl in ihrem Transkriptom und als auch in ihren Zellmarkern immer ähnlicher. Erst wenn sich aus dem Blastem wieder verschiedene Gewebetypen differenzierten, nahm auch die Heterogenität in der Zellpopulation wieder zu.
Die multipotenten Blastem-Vorläuferzellen ähnelten in ihren Eigenschaften denjenigen Zellen in Gliedmaßen-Knospen, aus denen in der Embryonal-Entwicklung die Beine hervorgehen. „Als wir mit dieser Arbeit begannen, war unklar, ob in ausgereiften, unverletzten Gliedmaßen blastemähnliche Zellen existieren, die sozusagen (nur) darauf warten, im Falle einer Verletzung aktiviert zu werden“, fasst Dunja Knapp, Postdoktorandin am DFG-Center for Regenerative Therapies Dresden, dieses Ergebnis in einer Pressemitteilung zusammen. „Jetzt haben wir sorgfältig Tausende von Zellen in unverletzten Gliedmaßen untersucht und keine solche Zelle gefunden. Das deutet darauf hin, dass eine Verletzung die Umprogrammierung ausgereifter Zellen in den Gliedmaßen stimuliert.“
Für ihre Experimente entwickelten die Forscher transgene Axolotl-Linien, bei denen einzelne Gewebetypen molekular markiert waren. Da ein Axolotl ein Jahr bis zur Geschlechtsreife benötigt, war dies ein recht langwieriges Verfahren. Transkriptionelle Veränderungen im Blastem wurden mit Hilfe von Einzelzell-mRNA-Sequenzierungen verfolgt. Mit diesen Methoden ließ sich das Blastem mit dem Gewebe unverletzter und regenerierter Gliedmaßen vergleichen. Während im unverletzten Bindegewebe viele Komponenten der extrazellulären Matrix nachweisbar waren, wurden diese im Blastem kaum gebildet. Kurz nach der Verletzung kam es zu einer starken Entzündungsantwort sowie einer verstärkten Tätigkeit von Matrix-Metalloproteinasen, die typischerweise am Abbau der extrazellulären Matrix beteiligt sind und somit eine wichtige Rolle beim Gewebeumbau im Kontext von Morphogenese, Wundheilung und Tumorwachstum spielen.
Das Rätsel der ersten Tage
Interessanterweise zeigten die Blastem-Zellen in den ersten elf Tagen ein deutlich anderes Transkriptionsmuster als die Zellen von embryonalen Gliedmaßen-Knopsen. Erst nach elf Tagen glichen sich diese beiden Zelltypen einander an. Bis zu 25 Tage blieben die Blastem-Zellen insgesamt relativ homogen, bevor dann die einzelnen Gewebetypen ausdifferenzierten. Zuerst kam es zu einer Aufspaltung in Nicht-Skelett- und Skelett-Zelllinien, dann trennten sich Knorpel- und Knochenzellen.
Auch bei Säugetieren reagieren die Bindegewebs-Zellen nach einer Verletzung mit einer Differenzierung. Allerdings verwandeln sich die Fibroblasten hier nicht in neue funktionsfähige Gewebe, sondern in Myofibroblasten, die unschöne und oft auch funktionell störende Narben bilden. Prayag Murawala, Postdoktorand im Labor von Elly Tanaka am Institut für Molekulare Pathologie in Wien, macht deutlich, dass es „keine ‚magische Zelle‘ gibt, die Axolotls haben, Säugetiere aber nicht. Beide sind im Falle einer Verletzung auf Fibroblasten angewiesen, aber während die einen Organe nachwachsen lassen können, bilden andere fibrotische Narben.“
Was genau unterscheidet die Fibroblasten der Salamander also von unseren? Was geschieht im Gewebe der Axolotl in den ersten elf Tagen nach einer Verletzung? Und ist es möglich, bei ausgereiften Säugetier-Zellen ähnliche Veränderungen auszulösen? Das gilt es nun herauszufinden!
Larissa Tetsch
Gerber T. et al. (2018): Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science, DOI: 10.1126/science.aaq0681