Holografische Mikroskopie
Kaupp leitet das Forschungszentrum Caesar (Center of Advanced European Studies and Research) in Bonn, ein Institut der Max-Planck-Gesellschaft. Erstautor Jikeli war sein Doktorand und arbeitet jetzt als Postdoc bei Caesar. „Bisher haben wir die Bewegung von Seeigel-Spermien immer nur zweidimensional auf Oberflächen untersucht“, berichtet Jikeli. Dabei schwimmen die Spermien auf kreisförmigen Bahnen zur Lockstoffquelle. In der Natur bewegen sich Seeigel-Spermien aber frei im Wasser; sie müssen sich also in einer dreidimensionalen Umgebung zurechtfinden.
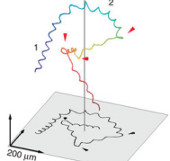
Mit klassischer Lichtmikroskopie kommt man daher nicht weit. Denn um die Spermien zu verfolgen, müsste man die Fokusebene dauernd wechseln. Das wäre viel zu langsam für Echtzeitaufnahmen, bestätigen Jikeli und Kaupp. Stattdessen kam die holografische Mikroskopie zum Einsatz. Dabei projiziert man kohärentes Licht durch eine Schwimmkammer auf einen Detektor. Spermien in der Flüssigkeit streuen das Licht und erzeugen so Interferenzmuster. Aus dieser Information kann man am Computer die räumliche Position der Zelle mikrometergenau errechnen und mit 600 Bildern pro Sekunde die Schwimmbahn verfolgen.
Während der Experimente bewegten sich die Spermien durch eine Schwimmkammer mit einem Volumen von etwa einem Kubikmillimeter. Dabei zeigten sie ein Verhalten, das auf zweidimensionalen Objektträgern nicht zu beobachten ist: „Die Spermien schwimmen auf helikalen Bahnen“, so Jikeli. „Gleichzeitig haben wir die Lockstoffkonzentration an der Position des Spermiums genau ermittelt“, ergänzt Kaupp. Hierzu wurden Resact-Peptide in einem lichtempfindlichen chemischen Käfig verpackt und im Medium gelöst. Mit UV-Licht lässt sich der Käfig aufbrechen, und der Lockstoff wird freigesetzt. Die Forscher schickten einen UV-Strahl durch die Mitte der Schwimmkammer. Dadurch entsteht ein Resact-Gradient um die mittlere Achse, denn je höher die Lichtintensität, desto mehr „Käfige“ brechen auf.
Da man das Lichtprofil kennt, lässt sich die Resact-Konzentration für beliebige Punkte innerhalb des Volumens zu einem bestimmten Zeitpunkt abschätzen.
Clevere Spermien
Für die Auswertung legten Jikeli et. al. das Lockstoffprofil und die Schwimmbahn übereinander. Von Interesse war immer nur die Resact-Konzentration dort, wo sich das Spermium am jeweiligen Messzeitpunkt aufhielt. Denn nur diese Messgröße hat Einfluss auf das Verhalten des Spermiums.
„Dann sehen Sie zwei periodische Funktionen, die um eine gewisse Phase gegeneinander verschoben sind“, erklärt Kaupp. Die eine Periode kommt zustande durch die Helix, die das Spermium beschreibt; es schwimmt nicht einfach geradeaus, sondern bewegt sich dabei im Kreis. Falls das Spermium senkrecht zum Gradienten schwimmt, ändert sich auch die Konzentration des Lockstoffs, der das Spermium ausgesetzt ist. Ebenfalls periodisch.
Doch während sich das Spermium in seinem Lauf durch die Helix dem Zentrum nähert, wird die Krümmung der Helix schwächer. „Dadurch richtet sich die Helix parallel zum Gradienten aus“, schlussfolgert Kaupp.
Im Gegensatz zum stochastischen chemotaktischen Verhalten vieler Bakterien zeigen die Spermien ein deterministisches Verhalten, schwärmt Kaupp: „Sie vermessen ihre Umgebung, zeitlich, während sie auf der Helix ihre Bahnen ziehen.“ Die Spermien korrigieren ihre Schwimmbahn minimal und richten die Helix dabei immer wieder zum chemotaktischen Zentrum hin aus. Manchmal schießt ein Spermium dabei im wahrsten Sinne des Wortes über das Ziel hinaus. Jikeli: „Wenn sie das bemerken, vollziehen sie sofort eine Kehrtwende und korrigieren ihren Fehler.“
Die Forscher haben auch ein Modell, um ihre Beobachtungen mit den bekannten molekularbiologischen Signalwegen zur Flagellensteuerung zusammenzubringen: Mit der Änderung der Lockstoffkonzentration auf der helikalen Bahn kommt es zu einer Oszillation der Calciumkonzentration in der Zelle. Bei jedem Calcium-Peak richtet sich das Flagellum neu aus. Befindet sich das Spermium auf dem richtigen Kurs, dann steigt die Konzentration des Lockstoffs stetig an. Es wird immer mehr cGMP produziert, so dass sich die Zelle kaum von der Hyperpolarisation erholen kann. Dadurch verringert sich die Calciumoszillation, und das Spermium vollführt nur noch sehr feine Kursänderungen.
Schwimmt die Zelle aber an der Eizelle vorbei, dann sinkt die cGMP-Konzentration plötzlich ab. Dabei entsteht ein starkes Calciumsignal, das eine entsprechend abrupte Korrektur der Richtung zur Folge hat.
cGMP im Lichtkäfig
Die Bonner Forscher überprüften ihr Modell, indem sie den Spermien cGMP verabreichten, das ebenfalls in einem lichtempfindlichen molekularen Käfig verpackt war. Über ein Lichtsignal konnten sie cGMP in der Zelle freisetzen und damit einen Lockstoffreiz simulieren. Über fluoreszierende Indikatoren verfolgten sie dann den Calciumeinstrom und konnten den Grad der Hyperpolarisation messen.
Besonders interessierte sich Kaupps Team für das Wendemanöver der Spermien, wenn sie an der Eizelle vorbeischwimmen und ihren Kurs schlagartig korrigieren. Dabei fällt die cGMP-Konzentration in der Zelle schnell ab, nachdem sie kurz zuvor über längere Zeit erhöht war – die Forscher sprechen von der „Off-Response“.
Wie erwartet führten kurze Lichtsignale von 180 und 500 Millisekunden zu einer Hyperpolarisation und einem Calciumeinstrom. Dauert das Lichtsignal aber eine ganze Sekunde – analog zu einer permanent steigenden Lockstoffkonzentration – kommt es beim Abschalten des Lichts zu einem erneuten Calciumeinstrom. Als habe das Spermium sein Ziel verfehlt und müsse kehrtmachen.
Kaupp und Jikeli würden gern wissen, ob auch andere Spermien ein ähnliches Navigationssystem nutzen. So bewegen sich die männlichen Säugergameten ja nicht durch ein dreidimensionales Medium, sondern über ein zweidimensionales Epithel. Kaupp hält es daher für möglich, dass verschiedene Organismen jeweils individuell zugeschnittene Navigationssysteme entwickelt haben. „Wir kennen die Antwort noch nicht“, so sein Resümee. Weitere Experimente seien aber geplant, verrät er.
Mario Rembold
Abb: Fig 3D, Jikeli et al. (CC-BY)
Letzte Änderungen: 14.01.2016