Die Behandlung von Krankheiten durch RNA-Interferenz - eine sichere Sache?
Eine aktuelle Studie von Kleinman et al. in Nature zeigt, dass therapeutische siRNAs unvorhergesehene Nebenwirkungen auf Immunsystem und Gefäße haben können – unabhängig von ihrer Sequenz und ohne Einschleusung in die Zielzellen.
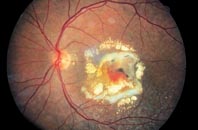
(18.04.2008) Der gelbe Fleck (Makula) in der Netzhautmitte des Auges ist der Ort des scharfen Sehens. Bei der feuchten Form der Makuladegeneration – einer Alterskrankheit – kommt es im späten Stadium zur Neubildung von undichten Gefäßen in der Aderhaut. Diese Gefäße geben Flüssigkeit und Blut ab, was zur Makulaschwellung führt, zur Vernarbung der Makula und zum Verlust des scharfen Sehens. Das krankhafte Gefäßwachstum wird durch eine überschießende Produktion von Vascular Endothelial Growth Factor-A (VEGF-A) ausgelöst. Dies und die vermehrte Expression des zugehörigen Rezeptors VEGFR1 (Vascular Endothelial Growth Factor Receptor 1) sollen die siRNA-Produkte
bevasiranib und
siRNA-027 unterdrücken.
Die Firmen Opko Health und Allergan testen die Produkte derzeit in klinischen Studien. Zur Behandlung werden die siRNAs in den Glaskörper des Auges gespritzt. Bisher nahm man an, dass die injizierten siRNAs die Gefäßneubildung in der Aderhaut durch Sequenz-spezifische RNA-Interferenz unterdrücken. Eine Studie von Kleinman
et al. an Mäusen in
Nature (Vol. 452: S.591-597) zeigt jedoch, dass jede Art von "nackter" siRNA mit einer Länge von mindestens 21 Nukleotiden unabhängig von ihrer Sequenz den gleichen hemmenden Effekt hat, ohne in die Zielzellen aufgenommen zu werden.
Die Studie belegt, dass die injizierten siRNAs die Laser-induzierte Gefäßneubildung im Auge hemmen, indem sie an den Toll-like Receptor 3 (TLR3) auf der Oberfläche von Endothelzellen der Aderhaut binden. TLR3 ist ein Vermittler der antiviralen Immunantwort und erkennt doppelsträngige RNA. In TLR3-Knockout-Mäusen, nach Co-Injektion von kompetierendem, löslichem TLR3 oder von neutralisierendem anti-TLR3-Antikörper wurde die Gefäßneubildung durch siRNA nicht gehemmt. Dagegen konnten
in vitro transkribierte doppelsträngige RNAs oder poly(I:C), die den TLR3 aktivieren, die Gefäßneubildung in der Aderhaut ebenfalls reduzieren. Die Bindung von siRNA an TLR3 induziert eine Signalkaskade, die über TLR3-Adapterprotein TRIF, Nuclear Factor-κB und Induktion von Interferon-γ und Interleukin-12 verläuft und schließlich die Gefäßneubildung hemmt.
Der durch siRNAs stimulierte TLR3 findet sich auf mehreren menschlichen endothelialen Zelltypen. Vor weiteren klinischen Versuchen mit RNA-Therapeutika sollten daher TLR3-abhängige Effekte von siRNAs auf den Gesamtorganismus untersucht werden. Samuel Reich, ein Vertreter von Opko Health, versichert, dass
bevasiranib nicht in den Blutkreislauf gelange und daher die Gefahr von Nebenwirkungen gering sei. Auch Allergan hält sein siRNA-Produkt für sicher. Alan Sachs, Vizepräsident für RNA-Therapeutika der Merck Research Laboratories, schlägt dagegen vor, die siRNAs in Lipidkügelchen zu verpacken und chemisch zu modifizieren. Dies würde den Eintritt der siRNAs in Zellen erleichtern und könnte eine Stimulierung des Immunsystems verhindern. In der Studie von Kleinman
et al. konnte an Cholesterol gekoppelte Maus-VEGF-A-siRNA in der Tat in Zellen aufgenommen werden, die VEGF-A-mRNA-Menge vermindert und die Gefäßneubildung in der Aderhaut von Mäusen unabhängig von TLR3 gehemmt werden.
Acht Prozent der Weltbevölkerung leiden unter Krankheiten, deren Ursache Gefäßneubildungen sind. Die Entdeckung von Kleinman
et al. legt nahe, dass man solche Krankheiten mit unspezifischen RNA-Therapeutika behandeln könnte. In der Tat konnte bei Mäusen die Gefäßneubildung in einer Hautwunde durch siRNAs sequenzunabhängig vermindert werden.
Bettina Dupont
Quellen: iht, Nature
Letzte Änderungen: 04.08.2008





 (18.04.2008) Der gelbe Fleck (Makula) in der Netzhautmitte des Auges ist der Ort des scharfen Sehens. Bei der feuchten Form der Makuladegeneration – einer Alterskrankheit – kommt es im späten Stadium zur Neubildung von undichten Gefäßen in der Aderhaut. Diese Gefäße geben Flüssigkeit und Blut ab, was zur Makulaschwellung führt, zur Vernarbung der Makula und zum Verlust des scharfen Sehens. Das krankhafte Gefäßwachstum wird durch eine überschießende Produktion von Vascular Endothelial Growth Factor-A (VEGF-A) ausgelöst. Dies und die vermehrte Expression des zugehörigen Rezeptors VEGFR1 (Vascular Endothelial Growth Factor Receptor 1) sollen die siRNA-Produkte bevasiranib und siRNA-027 unterdrücken.
(18.04.2008) Der gelbe Fleck (Makula) in der Netzhautmitte des Auges ist der Ort des scharfen Sehens. Bei der feuchten Form der Makuladegeneration – einer Alterskrankheit – kommt es im späten Stadium zur Neubildung von undichten Gefäßen in der Aderhaut. Diese Gefäße geben Flüssigkeit und Blut ab, was zur Makulaschwellung führt, zur Vernarbung der Makula und zum Verlust des scharfen Sehens. Das krankhafte Gefäßwachstum wird durch eine überschießende Produktion von Vascular Endothelial Growth Factor-A (VEGF-A) ausgelöst. Dies und die vermehrte Expression des zugehörigen Rezeptors VEGFR1 (Vascular Endothelial Growth Factor Receptor 1) sollen die siRNA-Produkte bevasiranib und siRNA-027 unterdrücken.