Bakterieller
Wasserstoff-Speicher
(08.06.2022) Mit dem Essigsäure produzierenden Acetobacterium woodii lässt sich eine Biobatterie betreiben, die Wasserstoff speichert und wieder freisetzt.
Ungemütlich aber durchaus real ist die Vorstellung, dass der Erdgas-Hahn in absehbarer Zeit von Russland abgedreht wird. Umso wichtiger ist es, einen Plan B für eine nachhaltige und unabhängige Energieversorgung zu haben. Der Knackpunkt ist aber nicht nur die Produktion von alternativer Energie, sondern ihre Speicherung. Wohin man schaut, lauern hier Probleme: So grün der Strom für Elektroautos auch sein mag, ohne Batterien läuft nichts. Die Ökobilanz von Batterie-Rohstoffen wie Lithium ist aber alles andere als grün. Und wenn eines Tages tatsächlich mit dem Strom von Windkraft- und Photovoltaik-Anlagen Wasserstoff per Elektrolyse in großen Mengen produziert wird, muss er irgendwo zwischengespeichert werden. Die Kapazitäten hierfür sind aber begrenzt, da Wasserstoff nur ein Drittel der Energiedichte von Methan aufweist und nur bis maximal zehn Prozent Erdgas beigemischt werden kann, weil Wasserstoff korrosiv ist. Zudem ist er explosiv und muss mit hohem Kosten- und Energieaufwand verflüssigt werden.
Eine Batterie, die Wasserstoff speichert und aus leicht verfügbaren und unbedenklichen Materialien besteht, würde viele Probleme der Energiewende lösen. Wie diese Fiktion mithilfe von ziemlich exotischen Mikroorganismen Realität werden könnte, zeigt Volker Müllers Gruppe von der Johann-Wolfgang-Goethe-Universität Frankfurt.
Bekannte Idee
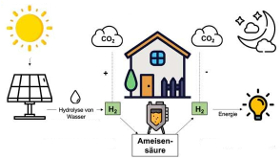
Die Frankfurter steuern sowohl das Aufladen als auch das Entladen der Biobatterie mit einem Enzymsystem aus dem acetogenen Bakterium Acetobacterium woodii, das die reversible Reaktion von Kohlendioxid und Wasserstoff zu Ameisensäure katalysiert. Die Idee Ameisensäure, alias Methansäure, für die Speicherung von Wasserstoff zu nutzen, ist nicht neu. 2018 hatten Forscher von der Ecole Polytechnique Federale de Lausanne eine Methansäure-Wasserstoff-Brennstoffzelle entwickelt (Link zur Pressemitteilung), bei der mithilfe eines Ruthenium-Katalysators Wasserstoff und CO2 aus Ameisensäure freigesetzt wird. Ruthenia heißt „Russland“ und ist ein seltenes Übergangsmetall. Auch für den umgekehrten Prozess, die Synthese von Ameisensäure aus Wasserstoff und CO2, sind Katalysatoren aus Edelmetallen sowie extreme Reaktionsbedingungen nötig.
Die Frankfurter nutzen hingegen den Enzymkomplex HDCR (Hydrogen-dependent CO2 Reductase) aus A. woodii für die Konvertierung der Ameisensäure. Die Bakterien kultivierten sie in einem Bioreaktor in komplexem Medium bis zur Sättigung und neutralisierten das Medium anschließend mit einem Phosphatpuffer. Danach spülten die Forscher H2, CO2 und N2 in den Bioreaktor, um die Ameisensäure-Produktion durch die Bakterien zu starten. Das entspricht dem „Ladevorgang“, denn der Wasserstoff wird in der wesentlich dichteren, leichter handhabbaren und transportfähigen Ameisensäure gespeichert. Zum „Entladen“ ließ das Team den Enzymkomplex in die Gegenrichtung arbeiten, indem es nur N2 in die Kulturflüssigkeit leitete. Jetzt katalysierte das Enzym die Umsetzung von Ameisensäure zu CO2 und H2. Letzterer kann aufgefangen und als Energieträger eingesetzt werden.
Robustes Bakterium
Um den Prozess möglichst realitätsnah zu gestalten, erfolgte die CO2-Hydrierung zu Methansäure in der Biobatterie acht Stunden lang. Die Gruppe imitierte hierdurch eine tagsüber stattfindende Elektrolyse durch eine Photovoltaik-Anlage. Anschließend setzten die Bakterien 16 Stunden lang Wasserstoff frei. Eine gute Batterie muss möglichst viele Ladezyklen durchhalten, ohne zu ermüden. In dieser Hinsicht scheint Acetobacterium woodii sehr robust zu sein. Über einen Zeitraum von 15 Tagen, sprich 15 Zyklen, änderte sich wenig an der ursprünglichen Zelldichte sowie der Proteinkonzentration.
Mit dem Ionophor Monensin hinderte das Team die Bakterien daran, ATP zu gewinnen, das diese für die weitere Umsetzung von Ameisensäure zu Essigsäure verwenden würden. Dieser Trick funktionierte aber nicht ganz perfekt. Effektiver war eine Mutante mit Methylen-THF-Reduktase-Defekt, die Ameisensäure von Haus aus nicht zu Essigsäure umwandeln kann. Diese schaffte auch im fünfzehnten Zyklus noch dreißig Prozent der ursprünglichen Ladungsleistung.
Andrea Pitzschke
Schwarz F. et al. (2022): Biological hydrogen storage and release through multiple cycles of bi-directional hydrogenation of CO2 to formic acid in a single process unit. Joule, DOI: 10.1016/j.joule.2022.04.020
Bild: Müller Lab