„Wackelpudding“ für die
CAR-T-Zell-Therapie
(20.04.2022) Solide Tumore sind mit CAR-T-Zellen nur schwer zu erreichen. Außer mit einem Hydrogel, das die Zellen mobil, vital und an Ort und Stelle hält.
Bei der adoptiven Zelltherapie mithilfe von Chimeric-Antigen-Receptor (CAR)-T-Zellen werden den Patienten Immunzellen entnommen und gentechnisch mit synthetischen Antigen-Rezeptoren versehen, die ein Antigen auf Krebszellen erkennen. Anschließend werden diese den Patienten über eine Transfusion wieder zurückgegeben.
Für die Rück-Infusion werden bei den gegenwärtigen Behandlungsstrategien jedoch sehr viele CAR-T-Zellen benötigt und die Infusion ist meist nur bei Blutkrebs erfolgreich – bei lokalen Tumoren erreichen viele der CAR-T-Zellen ihr Ziel nicht. Hinzu kommt, dass CAR-T-Zellen für ihre Immunkompetenz Cytokine benötigen, die in hohen Dosen aber toxisch sind und systemische Schäden verursachen können, wenn sie zu häufig verabreicht werden.
Inspiration aus der Stammzellforschung
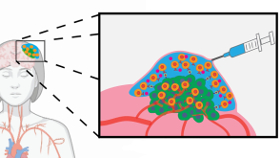
Erik Appels Team an der Stanford University hat sich eine Strategie überlegt, mit der man CAR-T-Zellen auch gezielt in die unmittelbare Umgebung solider Tumoren einschleusen kann. Diese Tumore sind mit der aktuellen CAR-T-Zell-Therpaie nur schlecht zugänglich. Dabei ließen sich die Forscher von der Stammzell- und Gewebezüchtung inspirieren, die quervernetzte Hydrogele für die Kultivierung von Zellen einsetzt.
Die von der Gruppe verwendeten Polymer-Nanopartikel (PNP)-Hydrogele bestehen aus einem Polymer (Dodecyl-modified hydroxypropylmethylcellulose, HPMC-C12) sowie biologisch abbaubaren Nanopartikeln (Poly(ethylenglycol)-b-poly(lactic acid), PEG-PLA-NP). Werden diese beiden Komponenten gemischt, bildet sich ein Netzwerk, das flexibel ist wie ein Wackelpudding und über einen weiten Temperaturbereich seine Konsistenz behält. Fügt man beim Anrühren des Hydrogels weitere Zutaten hinzu, etwa CAR-T-Zellen und Cytokine, bleiben diese in dem Netzwerk gefangen, sind jedoch in diesem noch beweglich und nicht vollends isoliert.
Interleukin ausgebremst
Je nach Konzentration von HPMC-C12 und PEG-PLA-NP lässt sich die Maschenweite des Hydrogel-Geflechts einstellen. Nach einigen Tests der Gruppe erwies sich ein Anteil von einem Prozent HPMC-C12 sowie fünf Prozent PEG-PLA-Nanopartikel als optimal für die mechanischen Eigenschaften des Hydrogels sowie für die Mobilität der darin gefangenen CAR-T-Zellen. Versuche mit angefärbtem Interleukin-15 (IL-15) bestätigten zudem, dass das PNP-1-5-Gel die Diffusion von IL-15 bremst. Die US-Forscher vermuten, dass die Verlangsamung der Diffusion durch hydrophobe Wechselwirkungen zwischen IL-15 und den Strukturen des HMPC-C12-Polymers verursacht wird. Nach einer Woche waren noch 80 Prozent der ursprünglich eingebrachten IL-15-Moleküle in dem PNP-1-5-Hydrogel enthalten. Um die Beweglichkeit und Vitalität der T-Zellen in dem Hydrogel zu verbessern, Griff das Team in die Trickkiste der Chemiker: Mithilfe der Klick-Chemie heftete die Gruppe dazu das Tripeptid Arg-Gly-Asp (RGD) an die Oberfläche der Nanopartikel.
Test an Mäusen mit Medulloblastom
Nachdem die Formulierung des PNP-Hydrogels optimiert war, beluden die Forscher das Gel mit den CAR-T-Zellen, indem sie die Zellen zunächst in der Nanopartikel-Lösung suspendierten und die Mischung danach in einer Spritze mit dem HPMC-C12-Polymer mischten.
Das mit den CAR-T-Zellen beladene Gel erprobte die Gruppe an Mäusen, denen sie humane Medulloblastom-Zellen (die einen bösartigen, soliden Hirntumor bilden) injiziert hatten. Fünf Tage nach der Injektion applizierten die Forscher den Mäusen CAR-T-Zellen intravenös in einer Lösung oder subkutan in dem Hydrogel, jeweils mit oder ohne IL-15. Nur in den Tieren, die das Hydrogel mit den CAR-T-Zellen sowie IL-15 erhalten hatten, fanden sie 24 Tage nach der Behandlung keine Tumorzellen mehr.
Andrea Pitzschke
Grosskopf A. et al. (2022): Delivery of CAR-T cells in a transient injectable stimulatory hydrogel niche improves treatment of solid tumors. Science Advances, 8(14):eabn8264
Bild: Grosskopf et al.