Geheimnisvolle Bodenwelt
Die Arbeitsgruppe von Axel Brakhage vom Leibniz-Institut für Naturstoffforschung und Infektionsbiologie in Jena hat sich darauf spezialisiert, den Bodenorganismen diese Geheimnisse zu entlocken. Erst als Doktorand und nun als Postdoc beschäftigt sich Mario Krespach dort mit dem Wechselspiel zwischen dem filamentösen Bakterium Streptomyces iranensis, Pilzen aus der Gattung Aspergillus und der Grünalge Chlamydomonas reinhardtii. Dabei hat er eher zufällig bei der in feuchten Böden häufigen einzelligen Grünalge C. reinhardtii einen Schutzmechanismus vor einem Naturstoff entdeckt, der ein ganz neues Licht auf die Evolution von Vielzellern wirft.
Einer der von S. iranensis gebildeten Sekundärmetaboliten ist das sogenannte Marginolakton Azalomycin F. „Marginolaktone sind Makrolaktone, unterscheiden sich aber dadurch, dass ihre Biosynthese mit Arginin oder Ornithin beginnt“, erklärt Krespach die Entstehung des Kofferworts Marginolakton. „Sie werden von vielen Aktinomyzeten, zu denen die Gattung Streptomyces gehört, produziert. Bekannt sind sie schon seit den 1950er- und 1960er-Jahren als Wirkstoffe, die gegen Gram-positive Bakterien, Pilze und neuerdings auch Algen wirken.“
Versteckt im Pilzmyzel
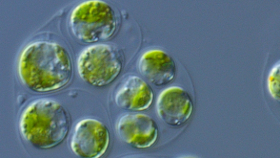
Auf C. reinhardtii wirkt Azalomycin F ab einer bestimmten Konzentration tödlich. Um dem zu entkommen, nutzt die Alge das Myzel des Schimmelpilzes Aspergillus nidulans als Versteck, weiß sich aber auch ohne Pilzpartner zu helfen, wie Krespach herausgefunden hat. Dazu bildet sie Zellaggregate, die aufgrund ihrer Ähnlichkeit mit Strukturen von Cyanobakterien der Gattungen Gloeocapsa und Gloeotheca den Namen Gloeocapsoide erhielten. „Die Gloeocapsoide wurden entdeckt, als wir untersuchen wollten, ob die Aktivität von Azalomycin F pH-abhängig sei“, erzählt der Mikrobiologe. Während bei pH 7 toxische Azalomycin-F-Konzentrationen die Algen abtöten, beobachteten Krespach und Co, dass „bei einem basischen pH von 8-9 Chlamydomonas reinhardtii stattdessen Aggregate bilden.“
Viele Algen schließen sich zum Schutz vor ungünstigen Einflüssen wie hohen Kochsalz-Konzentrationen zu mehrzelligen Komplexen zusammen, die außerdem zu groß sind, um von Fressfeinden verschlungen zu werden. Diese nach der in Zellclustern wachsenden Grünalge Palmella benannten Palmelloide sind schon lange bekannt. Sie entstehen, wenn sich die Tochterzellen nach der Zellteilung nicht aus der gemeinsamen Zellwand befreien können. Dadurch bleiben die Tochterzellen in einem Zellverbund zusammen, der von einer gemeinsamen Hülle umgeben ist.
Selbstgewählte Isolation
Als die Forscher Mikroskopie-Bilder von bereits bekannten Palmelloiden mit den neuen Gloeocapsoiden verglichen, entdeckten sie, dass sich diese im Aufbau unterscheiden. Auffällig war, dass die Zellen in den Aggregaten von vielen gemeinsamen Plasmamembranen und Zellwänden umgeben waren. Die äußerste Membran wirkte porös – möglicherweise weil sie von Azalomycin F, das wie alle Marginolaktone an der Plasmamembran wirkt, angegriffen wurde. Für Letzteres spricht auch, dass zwei strukturell verwandte Marginolaktone, Desertomycin A und Monazomycin, ebenfalls die Bildung von Zellaggregaten auslösen konnten, während strukturell verschiedene Verbindungen, die ebenfalls die Membran angreifen, wie Amphotericin B und Daptomycin, dies nicht tun. Eine Einkerbung in der äußeren Membran wies darauf hin, dass hier einst die Flagelle gesessen hatte und es sich deshalb wohl um die Zellhülle der ursprünglich freischwimmenden Mutterzelle handelt.
Ebenfalls ungewöhnlich ist die ausgedehnte Matrix aus sauren Polysacchariden, die sich zwischen dieser äußeren Membran und der nächsten Plasmamembran befindet. Im Unterschied zu den Einzelzellen waren dagegen nur wenige Lipidtröpfchen und Stärkekörnchen vorhanden, und es fehlten auch die sekretorischen Vesikel, mit denen die einzelligen Algen normalerweise mit ihrer Umwelt im Kontakt stehen. Dies deutet darauf hin, dass sich Gloeocapsoide von ihrer Umwelt isolieren. Die Aggregate wurden nur vorübergehend gebildet; wurde Azalomycin F entfernt, zerfielen sie innerhalb weniger Tage.
Auf dem Weg zur Vielzelligkeit
Um die Funktion der Gloeocapsoide aufzuklären, lösten Krespach und Kollegen zuerst ihre Bildung bei pH 7 aus und erhöhten dann den pH-Wert. Im Unterschied zu einzelligen Algen überleben die Zellen in den Aggregaten bei pH 10 und 11. Auch vor einer normalerweise tödlichen Azalomycin-F-Dosis waren sie geschützt. Für andere Palmelloide galt das nicht. Da Streptomyceten nicht nur Azalomycin F bilden, sondern auch den pH-Wert ihrer Umgebung aktiv erhöhen, um bakterielle Konkurrenten auszuschalten, sind die Gloeocapsoide optimal an den Schutz vor den Bakterien angepasst.
Aber wie kommt der Schutzeffekt zustande? Frühere Arbeiten (ISME J, 14(11):2794-2805) deuteten an, dass Azalomycin F an Lipide der Zellmembran seiner Zielzellen binden könnte. „Unsere derzeitige Hypothese ist, dass Azalomycin F durch seine Guanidylgruppe bei physiologischem pH eine positive Ladung trägt, die wichtig für seine Aktivität ist“, spezifiziert Krespach. „Wir vermuten, dass die für Gloeocapsoide typischen Extraschichten an Zellhüllen und die extrazelluläre Polysaccharid-Matrix Azalomycin F bindet und damit abfängt, sodass weniger Azalomycin F die darunterliegenden Zellen schädigen kann.“ Da die Alge aber ein paar Tage benötigt, um Gloeocapsoide zu bilden, kann sie sich nur an langsam steigende Azalomycin-F-Konzentrationen anpassen. Die Bakterien nutzen diesen Schwachpunkt wohl aus, indem sie den Giftstoff kontinuierlich produzieren und erst bei Kontakt mit der Alge in hoher Konzentration abgeben.
Spekulatives Szenario
Am Ende spekulieren die Forscher, dass die Gloeocapsoide am Anfang der Entwicklung von vielzelligen Organismen gestanden haben könnten. Dieser Schritt, der die Voraussetzung für Spezialisierung und Arbeitsteilung bei höheren Organismen war, wurde in vielen Algen-Ordnungen und auch bei den Chlamydomonadales vollzogen. Zwar zerfallen die Gloeocapsoide in Abwesenheit von Marginolaktonen schnell wieder. Sollten diese aber dauerhaft im Boden vorhanden gewesen sein, könnte das die Entwicklung zu echten mehrzelligen Grünalgen begünstigt haben. Da die entsprechenden Synthesegene bei viele bodenbewohnenden Aktinomyzeten vorkommen, scheint dieses Szenario gar nicht so abwegig.
Larissa Tetsch
Krespach M. et al. (2021): Bacterial marginolactones trigger formation of algal gloeocapsoids, protective aggregates on the verge of multicellularity. PNAS 118, e2100892118
Bild: M. Krespach (Leibniz-HKI)
Weitere Artikel zu Chlamydomonas
- Wie obskure Algenproteine zu den Lieblingen von Neurowissenschaftlern avancierten (Essay von Georg Nagel, Würzburg)
Die Optogenetik wurde 2010 von Nature Methods als „Methode des Jahres“ auserkoren. Bis sie ihren Siegeszug antreten konnte, war aber jede Menge zäher Laborarbeit nötig. Und wer viel arbeitet, macht hin und wieder auch Klonierungsfehler.
- Algen aufgepasst
Mikroben attackieren sich, Botaniker schauen tatenlos zu – und entdecken dabei eine neue chemische Kriegsführung. Die Grünalge Chlamydomonas reinhardtii führt einen aussichtslosen Kampf gegen Bakterien der Art Pseudomonas protegens. Mit einem speziellen Lipopeptid zwingen die Prokaryoten ihre Konkurrenten in die Knie.
- Appetit auf PET
Bachelor-Studenten der TU Kaiserslautern haben Grünalgen das Verdauen von Plastik beigebracht. Wie das gelang, erklärt uns Jungforscher Lukas Punstein.
Letzte Änderungen: 29.11.2021