Wenn kleine Kräfte sinnvoll walten
(31.1.17) Das Herz schlägt rund um die Uhr, ein Leben lang. Neben aktiver Kontraktion müssen die Herzmuskelfasern dabei auch passive Dehnung aushalten. Münchner Physiker maßen die Kräfte dahinter – und waren ziemlich überrascht.
Mit großer Kraft befördert das Herz Blut in alle Ecken unseres Körpers. Dabei arbeitet es als das im Embryo zuerst angelegte Organ überhaupt rundum zu jeder Uhrzeit. Das Muskelgewebe des Herzens zieht sich während der „Herzschläge“ rhythmisch zusammen, um danach passiv gedehnt zu werden – all dies, ohne dass dabei die Fasern ihre Verbindung verlieren. Die Proteinstränge, die den Muskel im Zuge dieses Prozesses zusammenhalten, sind zwar bekannt – nicht aber, mit welchen Kräften sie dies bewerkstelligen. Die beiden Physiker Matthias Rief und Marco Grison von der Technischen Universität in München (TUM) rückten dieser Frage mit schwerem „Labor-Geschütz“ zu Leibe. Und fanden erstaunlicherweise kleinere Kräfte als erwartet – weshalb jedoch gerade deren Effizienz so verblüffend ist (Proc. Natl. Acad. Sci. USA, publ. online 17. Jan.; doi: 10.1073/pnas.1612681114).
Um die Ergebnisse der Münchner besser zu verstehen, müssen wir jedoch einen Schritt zurückgehen und den Aufbau von Muskeln genauer betrachten. Die Muskulatur des Herzens beispielsweise kann in unterschiedliche Einheiten zerlegt werden. Die hier wichtige ist die Grundeinheit des Muskels, das Sarkomer. Es besteht unter anderem aus dicken Myosin-Filamenten und aus dünnen Filamenten, die hauptsächlich Actin enthalten.
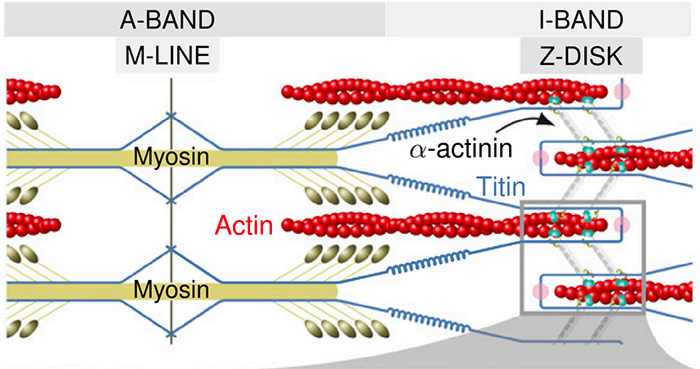
Organisation im Sarkomer (Grison et al., PNAS, doi: 10.1073/pnas.1612681114; Fig. 1A)
Die Actin-Filamente sind in der sogenannten Z-Scheibe an den Enden der Sarkomere verankert; die dicken Filamente liegen indes im Zentrum (M-Linie) des Sarkomers und werden von den Actin-Filamenten im entspannten Zustand leicht überlappt. Bei Krafterzeugung kontrahieren die Sarkomere durch die beiden Filamente und verkürzen sich.
Die entgegen gesetzte Bewegung, also die passive Dehnung, übernehmen hingegen die Titin-Filamente. Titin, das längste Protein im menschlichen Körper, hält die Muskelfilamente zusammen, indem es in der Z-Scheibe und M-Linie verankert ist.
Ein weiterer wichtiger Faktor für die Elastizität ist das α-Actinin. Es verknüpft Actin-Filamente von benachbarten Sarkomeren mit der Z-Scheibe. Die Z-Scheibe ist auch der Ort, an dem sich Titin und α-Actinin treffen und ebenfalls interagieren. Doch mit welcher Kraft Titin und α-Actinin die Muskeln beisammen halten, war dem Wissen der Menschheit bislang verwehrt gewesen.
Die Physiker Rief und Grison untersuchten deshalb die Bindungskraft zwischen Titin und α-Actinin mit ganz speziellem Werkzeug.
Einen ganzen Raum füllt das Gerät, das die Münchner als „Optische Pinzette“ betiteln (siehe hier). Hauptkomponente der ausgeklügelten Technik sind Laserstrahlen, mit denen kleinste Objekte gegriffen werden können. Grundvoraussetzung für das „Greifen“ eines Objektes ist, dass es für das verwendete Laserlicht durchsichtig ist. In diesem Fall entsteht zwischen Laser und etwa einem Glaskügelchen eine Kraft, die das Objekt in das Zentrum des Strahls zieht und dort fixiert. Zum besseren Verständnis des Funktionsprinzips einer Optischen Pinzette hat die TUM das folgende Video hochgeladen:
Entfaltung von Proteinen in einer optischen Falle von NIM auf Vimeo.
Wie in dem Video zu sehen ist, können die beiden Laserstrahlen die Glaskügelchen zuerst nah genug zusammen bringen, damit eine Bindung der Proteine stattfindet. Anschließend werden sie so weit auseinander gezogen, bis die maximale Dehnung erreicht ist. Danach können die Proteine entweder auseinanderreißen oder aufgefaltet werden.
Die Münchner befestigten wie im Clip dargestellt die Titin-α-Actinin-Verbindung mittels doppelsträngiger DNA an den Glaskügelchen. Und nach etlichen Versuchen kamen Rief, Grison und Co. aus dem Staunen nicht mehr heraus. Die gemessene Kraft, welche die Verknüpfung von Titin und α-Actinin aushalten konnte, betrug läppische 3,5 Piconewton – was der Gewichtskraft einer Billionstel Tafel Schokolade entspricht. Klingt nicht nur sehr schwach, sondern scheint es im Vergleich zu den Größenordnungen bei anderen Muskeln auch tatsächlich zu sein. Denn Proteine, die für die Stabilität und Mechanik des Muskelgewebes verantwortlich sind, sind viel stabiler.
Wie etwa die Titin/Telethonin-Interaktion: Sie gehört mit einer Kraft von zirka 800 Piconewton zu den stabilsten nicht-kovalenten Verbindungen überhaupt. Und auch die Titin-Ig-Domäne entfaltet sich erst bei Kräften um 200 Piconewton. „Derart geringe Kräfte können einen Muskel eigentlich nicht dauerhaft zusammenhalten“, zitierte denn auch eine Pressemitteilung der TUM zu den Titin-α-Actinin-Messwerten einen scheinbar enttäuschten Matthias Rief.
Doch die Ergebnisse waren eindeutig. Irgendetwas mussten die Physiker übersehen haben.
Und dem war tatsächlich so. Denn im Sarkomer in der Z-Scheibe wird jeder Titin-Strang von bis zu sieben α-Actinin-Proteinen gehalten. Das macht den Bock auf den ersten Blick zwar auch nicht viel fetter, Rief und Co. vermuteten jedoch, dass die dadurch entstehenden Kräfte ausreichen würden. Aber wie kommen sie darauf?
Nun, gerade die vielen, dynamisch zusammenarbeitenden Verbindungen bilden eine stabilere Verankerung, als man zu Beginn annehmen würde. „Außerdem“, so meint Rief, „kann die genaue Verteilung der Kräfte bei mehreren Bindungen kompliziert werden.“ Das bedeutet: Die gemessene Kraft von 3,5 Piconewton entspricht nicht der Realität. Rief et al. schätzen vielmehr, dass es sich eher um 10 Piconewton handelt. Und auch die physiologisch relevanten Kräfte entsprechen nicht den Vorstellungen vieler: Schätzungsweise muss ein einzelnes Titin-Molekül nur 5 Piconewton im Gewebe aushalten – das allerdings über Stunden.
Und hier liegt der eigentliche Knackpunkt der Geschichte: Denn die Kräfte, die im Muskel wirken, sind zeitabhängig. Die erwähnte Titin-Ig-Domäne toleriert zwar eine stattliche Last von 200 Piconewton, bevor sie entfaltet, das aber nur, wenn die Kraft über Bruchteile von Sekunden wirkt. Die Titin-α-Actinin-Verbindungen hingegen können bei dynamischem Zusammenwirken Kräfte von 5 bis 10 Piconewton über Stunden standhalten.
Die besondere Fähigkeit von Titin und Co. besteht also darin, zwar kleine Belastung auszuhalten. das aber sehr ausdauernd und verlässlich. Damit hatten Rief und seine Kollegen zu Beginn nicht gerechnet. Aber man lernt ja bekanntermaßen nie aus.
Juliet Merz








