Tipp 86:
Gewusst wie
Luminometer für Arme
Nicht jedes Labor besitzt ein Luminometer. Die Dinger sind mit Preisen zwischen 3000 und 30.000 Euro ja auch nicht gerade billig. Was jedoch ist zu tun, wenn man trotzdem gelegentlich Lichtblitze messen muß? Nina Baltes und Ilse Jacobsen vom Institut für Mikrobiologie der Tierärztlichen Hochschule Hannover standen vor diesem Problem, als sie die transkriptionelle Protein-of-Interest-Luziferase-Fusion testen wollten.
Nach ein wenig Herumexperimentieren entdeckten die beiden jedoch, dass die Luziferase von Photorhabdus luminescens in der Lage ist, Röntgenfilm zu schwärzen. Dies nutzten Baltes und Jacobsen für einen einfachen Assay aus: "Man züchtet seine Bakterien/Zellen/Was-auch-immer unter den entsprechenden Bedingungen an, füllt 2,5 ml in 24-Well-Platten (am Besten in schwarze mit durchsichtigem Boden, beispielsweise Lumox Multiwell von Greiner), gibt gegebenenfalls noch das Substrat dazu, begibt sich zügig in die Dunkelkammer und legt einen Röntgenfilm auf.
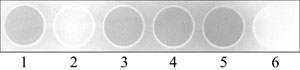
Nach drei bis zehn Minuten (je nach Konstrukt und Induktion) entwickelt man den Film - et voilá! - schwarze Kreise zeigen Luziferaseaktivität an! Legt man einen Film unter die Platte (durchsichtiger Boden vorausgesetzt) und eine darauf, kann man in einem Rutsch zwei unterschiedliche Expositionszeiten testen. Möchte man während der Exposition nicht in der Dunkelkammer bleiben, kann man sich für wenig Geld mit ein wenig Zeit und Geschick einfach eine lichtdichte schwarze Kiste aus dickem Fotokarton bauen, Röntgenfilm und Platte dort hineinstellen, und den Raum verlassen/betreten.
Vorteile und Nachteile
Der Vorteil: Das Verfahren geht schnell und ist billig. Es bietet sich an, wenn man gerade anfängt, mit Luziferase als Reporter-Gen zu arbeiten und kein Luminometer zur Verfügung hat.
Die Nachteile: Die Methode klappt nicht mit Firefly-Luziferase. Zudem hat man keinen Standard zur Quantifizierung - es soll aber Röntgen-Standards geben, die man einsetzen könnte (wir haben das noch nicht getestet, vielleicht haben aber andere Laborjournal-Leser bereits Erfahrung damit?).
Keine Rolle spielt der fehlende Standard, wenn man lediglich zwei oder mehr (bis 24 pro Platte!) Anzuchtbedingungen o. ä. direkt miteinander vergleichen will. Dann funktioniert diese Methode wunderbar. Und publizieren kann man die Ergebnisse dann auch, wie man an der nachfolgenden Abbildung erkennen kann, die sich in Infection and Immunity (Ausgabe 73) findet.
Letzte Änderungen: 11.01.2006