Tipp 145:
Infrarot fluoreszierender Reporter
Das
Leishmania tarentolae-Expressionssystem ist noch nicht in vielen Laboren verbreitet, weil es zeitaufwändig ist. Wie man diesem Verfahren mit dem IF-Protein Beine machen kann, erklärt Hakan Dortay.
Mit dem kürzlich vorgestellten Infrarot-fluoreszierenden Protein (IFP) hat der GFP-Papst und Nobelpreisträger Roger Y. Tsien die Fluoreszenzprotein-Palette um eine weitere Farbnuance bereichert. Tsiens Gruppe exprimierte eine optimierte Variante des aus dem extremophilen Bakterium
Deinococcus radiodurans stammenden IFP als Reporterprotein in der Leber von Mäusen. Weil die Infrarotstrahlung das Gewebe problemlos durchdringt und auch keine störenden Hintergrundsignale auftreten, konnten Tsiens Mitarbeiter die Leber in einem Infrarot-Fluoreszenz-Bild sichtbar machen (Shu
et al.,
Science 2009, 324:804-7).
IFP ist aber nicht nur als Reporterprotein für „Ganzkörper-Aufnahmen“ von Mäusen geeignet. Wir haben IFP eingesetzt, um in einem
Leishmania tarentolae-Expressionsystem frühzeitig gut exprimierende Leishmania-Zelllinien, direkt im flüssigen Expressionsmedium und ohne Zellaufschluss, auszuwählen (Dortay und Mueller-Roeber,
Microbial Cell Factories 2010, 9:29). Mit der von uns entwickelten IFP-Detektionsmethode lässt sich die Proteinexpression in Leishmania erheblich beschleunigen und vereinfachen. Darüber hinaus kann man mit ihr IFP und IFP-Fusionsproteine direkt nach der Auftrennung im denaturierenden SDS-Polyacrylamidgel detektieren, ohne das Gel aus dem Sandwich „Glasplatte-Proteingel-Aluminiumplatte“ entnehmen zu müssen.
Konkret funktioniert unser modifiziertes System wie folgt:
Für die Expression in
Leishmanien verwenden wir das „LEXYcon Expression Kit“ (Jena Bioscience). Im ersten Schritt transformiert man die Kassetten für die Expression von IFP und IFP-Fusionsproteinen per Elektroporation in die Zellen. Ungefähr 20 auf Selektivmedium angewachsene Kolonien transferiert man nachfolgend in 96-Well-Mikrotiterplatten (150 µL Selektivmedium), inkubiert sie zwei Tage und zentrifugiert kurz ab (1min, 2000g). Anschließend analysiert man die Proteinexpression direkt in der Mikrotiterplatte mit einem Infrarot Imaging System (LI-COR; 700 nm, 4 mm Focus Offset).
Das Ergebnis wird digital dokumentiert und alle Zelllinien mit einer Mehrkanalpipette nach dem Resuspendieren in die Vertiefungen einer sterilen 24er Deep-Well-Platte (1 mL Selektivmedium) überführt. Die Platte dichtet man mit einer luftdurchlässigen Abdeckfolie (HJ-Bioanalytik) ab und inkubiert sie weitere zwei Tage. Dabei hat es sich bewährt, auf die 24er Deep-Well-Platte eine zusätzliche leere Platte oder den Deckel einer Mikrotiterplatte zu platzieren. Ohne diese bildet sich an der Abdeckfolie Kondensfeuchtigkeit, die nach zweitägiger Inkubation in jedem Well zu einen Flüssigkeitsverlust von circa 50 µL führt.
Helle Kandidaten
Anschließend pipettiert man erneut jeweils 50 µL der Expressionskulturen in die Vertiefungen einer 96er Mikrotiterplatte und schaut sich die Protein-Expression im Infrarot-Imaging-System an. Dabei vergleicht man die Infrarot-Signalintensitäten (Tag 2 in Mikrotiterplatten und Tag 4 in Deep-Well-Platten) und wählt von den 20 zufällig selektierten Kolonien maximal vier stark fluoreszierende Kandidaten für das Scaling-Up aus. Diese transferiert man komplett (ca. 1 mL) in Gewebekulturflaschen (9 mL Selektivmedium) und inkubiert sie für weitere zwei bis fünf Tage (Protein-abhängig). Um den Verlauf der Proteinexpression verfolgen zu können, pipettiert man jeden Tag 50 µL für die Infrarot-Analyse in Mikrotiterplatten.
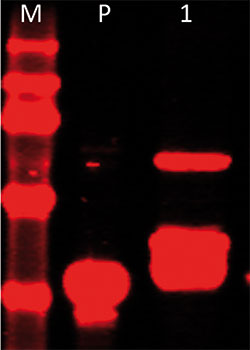
Sobald eine Sättigung im Infrarot-Signal zu erkennen ist, entnimmt man 7 mL aus den Expressionskulturen und schließt die pelletierten Zellen durch Ultraschallbehandlung in 400 µL Tris- oder PBS-Puffer auf (Puffer supplementiert mit 0,1mM EDTA und anderen Proteaseinhibitoren). Nach der Ultrazentrifugation des Zell-Lysats trennt man die Proteine in der unlöslichen Pellet- und in der löslichen Überstands-Fraktion per SDS-PAGE. Das Proteingel nimmt man nach der Elektrophorese samt Glas- und Aluminiumplatte aus der Elektrophoresevorrichtung, und scannt es mit der Glasseite nach unten im Infrarot-Scanner (700 nm, 1,5 mm Focus Offset).
Detektion im Gel
Mit dieser sogenannten „In-Gel-Detektion“ lässt sich das Molekulargewicht des IFP-Fusionsproteins direkt im denaturierenden Proteingel ermitteln und man kann auf die Zeit und Geld kostende immunologische Detektion verzichten. Die restlichen, nicht verwendeten Zellkulturen (maximal zwei Zelllinien), dienen dazu, die Kulturen zu erhalten und die Proteinaufreinigung im größeren Maßstab durchzuführen sowie für die Herstellung von Glycerin-Stocks.
Mit dem Infrarot-fluoreszierenden Protein kann man alle Arbeitschritte bei der Proteinaufreinigung per Infrarot-Analyse verfolgen. Anhand der Analyseergebnisse lässt sich zum Beispiel abschätzen, wie oft man die Proteinprobe über die Säule rezirkulieren muss, um eine vollständige oder bessere Bindung des Zielproteins an das Säulenmaterial zu erzielen. Zudem eignet sich IFP auch als Reporterprotein für die parallele Proteinproduktion in verschiedenen Expressionssystemen sowie für in vitro-Protein-Protein- und Protein-DNA-Interaktionsanalysen. Dazu mehr in unserer nächsten Publikation.
Hakan Dortay
(Institut für Biochemie und Biologie,
Universität Potsdam)
Letzte Änderungen: 15.12.2010