Tipp 109:
Datenerfassungs-Programm für klinische Studien
Die Aussagekraft klinischer Studien hängt von der genauen Erfassung der Probandendaten ab. Wenn sich hier Fehler einschleichen, kostest es viel Zeit die Daten zu korrigieren oder die Studie ist im schlimmsten Fall wertlos. Um dem Vorzubeugen, entwickelte Mathias Faix mit seinen Kollegen an der Uni Bonn ein Programm für die sichere und schnelle Datenerfassung über das Internet.
Faix ist Datenbank- und Netzwerkadministrator an der Informationszentrale gegen Vergiftungen der Universität Bonn. Dort verwaltet er nicht nur tausende von Sichersheitsdatenblättern auf die die Ärzte des Zentrums, etwa beim Verdacht auf eine Vergiftung, zugreifen können. Als Computer und Netzwerkspezialist ist er ständig in seinem Institut auf Achse um Computer -Probleme zu lösen oder neue Programme zu schreiben und einzurichten, die Medizinern und Wissenschaftlern die Arbeit erleichtern sollen.
"Die Erfassung von Probanden- oder Patientendaten bei klinischen oder medizinischen Studien ist ein grundsätzliches Aufgabengebiet in der Medizin. Vielfach werden die Daten lokal erfasst und in einem Studienzentrum gesammelt. Diese Vorgehensweise hat einige Vor- aber auch eine Reihe von Nachteilen. Oft werden die Patientendaten mittels Varianten der üblichen Desktop Datenbanken wie ACCESS oder FILEMAKER verwaltet. Diese erleichtern die Arbeit der Programmierer und die Krankenschwestern können in der Nacht ihre Daten leicht eingeben und wähnen sich so in Sicherheit. Die Daten werden dann meist per Diskette, CD oder manchmal auch in Form einer Mail an die Sudienzentrale geschickt. Dort "poolen" sie die Mitarbeiter und - es tauchen Fehler auf. Die Daten sind unleserlich, schlecht geprüft oder voller Fehler. Die Arbeit der Menschen in der Studienzentrale besteht darin, die Daten zu korrigieren und Kontakt mit den einzelnen Kliniken aufzunehmen. Je mehr Zentren an die Studie angeschlossen sind desto höher der Aufwand für die Überprüfung der Daten.
Wir (Arne Simon: Projektleiter; Carola Seidel: Ideengeberin und Matthias Faix: Entwickler, Datenbank Berater) wollten die Datenerfassung und Verwaltung anderst lösen. Uns schwebte eine auf dem Internet basierende Lösung vor, die so ansprechend und schnell ist wie ACCESS, eine zentrale Datenhaltung ermöglicht, die Daten direkt auf Plausibilität überprüft, den Anschluss an Statistikpakete ermöglicht, wiederverwendbar ist und die, last but not least, einen gesicherten Zugang hat.
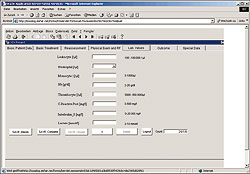
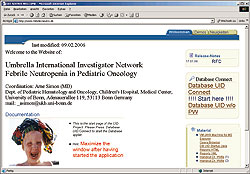
Unter Berücksichtigung dieser Vorgaben entwickelten wir die "Umbrella Internet Database" (UID) für die Dateneingabe und Verwaltung bei multizentrischen Studien. In einem ersten Probelauf setzen wir UID für die medizinische Studie "Febrile Neutropenie", ein, die unter Federführung von Arne Simon am Zentrum für Kinderheilkunde Abt. f. pädiatr. Hämatologie u. Onkologie der Universität Bonn stattfindet. Krebspatienten durchlaufen häufig eine Phase, die als "Fiebrige Neutropenie" bezeichnet wird. In dieser Phase ist ihr Zustand kritisch und ihre medizinisch relevanten Daten sowie die vom Arzt angesteuerte Therapie werden erfasst. Das Programm ist seit geraumer Zeit Online und kann auf der Webseite www.febrile-neutro.de kostenlos getestet werden (Einzelheiten zu UID stellt Matthias Faix in einem Vortrag am 15.11.2006 auf der 19. Deutschen ORACLE-Anwenderkonferenz in Mannheim vor).
UID verwaltet die Stammdaten der Patienten (die in besonderem Maße schützenswürdig sind), ihre phsysiologischen Daten (Temperatur, Zellzahlen, Befinden), Behandlungsdaten und den Ausgang der Behandlung. UID basiert auf der Datenbank Oracle 10G und dem Oracle-Frontendentwicklungsystem FORMS (Frontends sind Programme, die eine Oberfläche, zum Beispiel eine Eingabemaske, für andere Programme zur Verfügung stellen). Um die Arbeit effizient zu gestalten, haben wir viele Details, die in Studien immer wieder vorkommen als Vorlagen (Templates) gespeichert und können diese innerhalb kürzester Zeit für andere Studien anwenden. Wir entwickeln diese mit definierten und geprüften Oracle-Bausteinen, so genannten Beans.
Ein Beispiel hierfür ist die Temperaturerfassung, die bei vielen Erkrankungen nötig ist. Zunächst prüfen wir über den Browser, welche Ländereinstellung gültig ist. Temperaturen werden in vielen Ländern nicht SI konform erfasst. So messen englische Ärzte die Temperatur ihrer Patienten in Fahrenheit, deutsche in Celsius und Datenbanken speichern sie schließlich in Kelvin. Die Meta-Datenbank MedRep (Medical Repository) fasst diese Regeln in einem medizinischen Repository zusammen und stellt sie UID zur Verfügung.
Als Zeitrahmen für die Erstellung einer neuen Studienerfassung mit UID sehen wir zwei Wochen vor. UID ist von der Ethik Kommission abgenommen, so dass dem Einsatz bei einer neuen Studie mit Hinweis auf die Zulassung nichts im Weg steht. Oracle ist auf vielen universitären Rechenzentren verfügbar (derzeit plant das Land NRW den Erwerb einer Rahmenlizenz).
UID können Sie jederzeit auf der angegebenen Webseite testen. Krankenhäuser und interessierte Personen bekommen Zugang für die Online Version nach Rücksprache mit den an dem Projekt Beteiligten Personen. Die Eingabe in der Online Version bietet für Interessenten folgende Vorteile: die Daten sind von überall in der Welt einsehbar, sie sind zugriffssicher und auf Plausibilität geprüft und es stehen High Level Auswertetools zur Verfügung (Oracle Reports).
Für die Nutzung von UID respektive MedRep für Ihre eigenen Studien benötigen Sie zwei Lizenzen. Zum einen eine von Oracle. Für Lehre und Forschung können Sie diese entweder gratis oder stark ermässigt erwerben. Die MedRep Materialien sind von uns nach Rücksprache zu beziehen. Die Auslieferung kann über VMWARE-Sitzungen erfolgen, so dass noch nicht einmal Installationsarbeiten vor Ort nötig sind."
Informationen:
Matthias.Faix@ukb.uni-bonn.de
skype a1594656
www.febrile-neutro.de
Weiterführende Literatur:
http://www.oracle.com/technology/documentation/forms.html
http://orafaq.com/faqplsql.htm
http://www.oracle.com/technology/products/forms/index.html
Letzte Änderungen: 21.11.2006