Kontaminationen in der Zellkultur
Das betretene Schweigen
von Sabine Pils
Kontaminationen in der Zellkultur sind ein häufig unterschätztes Problem. Noch häufiger wird darüber geschwiegen, und fast immer bedeutet es den Verlust der betroffenen Kultur. Doch Totschweigen verhilft nur äußerst selten zum ersehnten Science-Paper. Ein Bericht über die Gefahr, die aus der Kälte kommt.
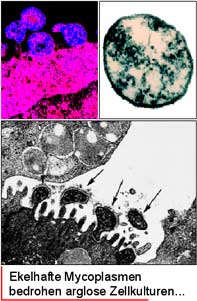
Alles begann damit, dass in unserem Labor eine größere Anzahl von Zellklonen, die in Flüssigstickstoff eingefroren waren, zur Analyse aufgetaut werden mussten. Es stellte sich heraus, dass viele der aufgetauten, eigentlich adhärenten Klone sich hartnäckig weigerten anzuwachsen und damit unwiederbringlich verloren gingen. Diesen unerwarteten Verlust waren wir nicht bereit ohne weitere Ursachenforschung hinzunehmen und so entschloss ich mich, der Sache auf den Grund zu gehen. Einen Verdacht und damit ein ziemlich ungutes Gefühl hatte ich aberschon... An einigen Zellen versuchten wir deshalb einen einfachen Farbtest durchzuführen. Der Test beruht auf dem Nachweis von Mycoplasmen-DNS mittels des Fluoreszenzfarbstoffes DAPI (siehe Kasten Seite 68).
Winterliche Romantik am Zellklon
Ist eine Kultur positiv, zeigt sie charakteristische Merkmale: es tritt eine deutliche Randfluoreszenz am Zytoplasmasaum auf und manchmal neigen befallene Zellen auch zu verstärkter Vakuolisierung. Liegt eine starke Kontamination vor, erscheinen die Zellen mitsamt der zytoplasmatischen Ausläufer wie mit Puderzucker überstreut. Das ganze Szenario erinnert sehr an eine winterliche Schneelandschaft. Leider ist das Problem der Mycoplasmeninfektion in der Zellkultur weit weniger romantisch als das sichtbare Erscheinungsbild beim DAPI-Test. Der Blick ins Fluoreszenzmikroskop bestätigte dann auch schließlich meine schlimmsten Befürchtungen: Mycoplasmen!!! Eine eingehende Analyse aller aufgetauten Klone ergab, dass auch alle anderen Kulturen mehr oder weniger stark infiziert waren - eine echte Massenverseuchung also.
Kontaminationen in der Zellkultur sind keine Seltenheit; glaubt man den Literaturangaben, so sind zwischen fünf und 85 Prozent aller Zellkulturen eines Labors mit Mycoplasmen infiziert. Kontaminationen dieser Art sind eine ständige Gefahr für laufende Experimente auf Zellkulturbasis, da eine Infektion zunächst meist unentdeckt bleibt. Erst wenn die Mycoplasmen die Wirtszellen überwachsen haben, wird der Befall sichtbar und die Kultur muss entweder verworfen oder eine Antibiotika-Behandlung durchführt werden.
Radikallösung: Alles wegwerfen!
Die Ursachen von Kontaminationen sind oft nur schwer auszumachen. Die Anzahl der Möglichkeiten ist hoch und genau das macht es so schwierig, Probleme dieser Art in den Griff zu bekommen. In der gängigen Literatur zum Thema wird fast immer empfohlen, die kontaminierten Kulturen zu verwerfen, damit sich die Infektion nicht weiter ausbreitet. Im vorliegenden Fall war eine solche Lösung aber inakzeptabel weil damit meine experimentelle Grundlage verloren gewesen wäre.
Oft sollen Zellen oder Klone, die das Ergebnis langwieriger Experimente sind, mit verschiedenen Methoden untersucht werden, damit ein abgerundetes Bild entsteht. Da man das meistens nicht zeitgleich durchführen kann, werden wertvolle Zellen, Klone oder Zellinien durch Kryokonservierung bis zur weiteren Verwendung in einem Flüssigstickstoffbehälter aufbewahrt. Aber genau hier liegt schon eine der möglichen Kontaminationsquellen.
Weitere sind neu ins Labor eingeführte Zelllinien, Zellkultursupplemente wie tierische Seren und natürlich die Experimentatoren selbst. Eine der häufigsten Mycoplasmenarten, nämlich Mycoplasma orale entstammt z.B. dem Mund- und Rachenraum. Wer also ein aussergewöhnlich starkes Mitteilungsbedürfnis hat, sollte das zumindest während der Arbeit an der Sterilbank unterdrücken und es sich lieber für den nächsten Friseurbesuch aufsparen.
Happy in Flüssigstickstoff
Ist erst einmal eine Kontamination da, können auch Nachlässigkeiten beim sterilen Arbeiten zum Befall von Medien und zur Flächenkontamination von Inkubatoren und Sterilbänken führen. In unserem Fall kamen die Mycoplasmen tatsächlich der Stickstoffbehälter, um genau zu sein der Flüssigstickstoff selbst. Aber was zum Teufel sind denn das für Biester, die solche Temperaturen aushalten können und damit jedem, der mit Zellkulturen experimentiert, das Leben schwer machen?
Mycoplasmen sind die kleinsten sich selbst vermehrenden Prokaryonten und stehen in der mikrobiologischen Klassifizierung zwischen Bakterien und Viren. Sie verursachen bei Menschen und Tieren hauptsächlich Erkrankungen des Bronchial- und Urogenitaltraktes. Man fasst sie auch mit anderen bakteriellen L-Formen zur Gruppe der Pleuropneumonia-like Organisms (PPLO) zusammen. Im Gegensatz zu ihren Artgenossen haben Mycoplasmen aber keine Zellwand und sind auch kleiner als normale Bakterien. Ihr Durchmesser schwankt zwischen 0,2 und 2 µm, was ihnen sogar die Passage durch einen Sterilfilter ermöglicht.
Mycoplasmen wachsen intrazellulär und ernähren sich parasitär von den Nährstoffen und Stoffwechselprodukten ihrer Wirtszellen. Das in der Zellkultur vorhandene Überangebot an Nährstoffen bietet geradezu optimale Wachstumsbedingungen für Mycoplasmen, die dann munter die Eigenschaften der befallenen Zellen verändern. Sichtbare Merkmale sind z.B. eine starke Vakuolisierung, abgerundete Zellen mit verminderter Adhärenz, sowie ein körniges Aussehen. Dieses beruht darauf, dass infizierte Zellen Bestandteile der extrazellulären Matrix ansammeln, die man im Inversmikroskop als dunkle Pünktchen auf der Zelloberfläche erkennen kann.
Kleine Arginin-Fresser
Die Eingriffe der Mycoplasmen in den Stoffwechsel der Wirtszellen sollen vielfältig sein, aber am besten belegt ist das laut Literatur bisher für Mycoplasmenarten, die Arginin spalten. Bei einer Myco-Infektion werden die Zellen unter normalen Kulturbedingungen in einen Arginin-Mangelzustand versetzt. Die Zellen kümmern vor sich hin, wobei dem Medium keine erkennbare Veränderung anzusehen ist. Farbumschläge des Mediums sind häufig ein zuverlässiger Hinweis auf eine Infektion.
Abgesehen von diesen Beobachtungen aber weiss wohl niemand so genau, was diese kleinen Teufel sonst noch anrichten. Eine meiner Lieblingshypothesen ist, dass sie die Adhärenz-Eigenschaften verändern (abgerundete Zellen!), was sich dann besonders beim Auftauen von eingefrorenen Zellen auswirkt. Die Kryokonservierung ist für die Zellen ein Stressfaktor, den nur ausgesprochen vitale Zellen einigermassen unbeschadet überstehen.
Mykoplasmeninfektionen könnten einen weiteren Teil dazu beizutragen, dass eingefrorene Zellen nach dem Auftauen nicht anwachsen wollen. Das ist aber wirklich nur eine unbewiesene Vermutung von mir (quod erat demonstrandum!).
Fest steht jedenfalls, dass eine unentdeckte Mycoplasmeninfektion zu Effekten führen kann, die so manches Ergebnis auf der Basis von Zellkulturexperimenten eher fragwürdig erscheinen lässt. Welches Labor gibt denn schon offen zu, Probleme mit seiner Zellkultur, geschweige denn Kontaminationen zu haben?
Kontrollieren tut not!
Da Kontaminationen mit PPLO im allgemeinen chronisch verlaufen, muss man ständige Kontrollen durchführen, um eine Infektion auszuschließen. Der dauerhafte Einsatz von Antibiotika (Kanamycin, Penicillin) in den Zellkulturmedien kann Kontaminationen sogar begünstigen, da die Infektion zwar unterdrückt, jedoch nicht beseitigt wird. Zudem bilden sich nach einiger Zeit mit unterdosierten Antibiotika resistente Organismen aus, die dann unterschwellig die Kultur infizieren. Ist eine Kultur positiv getestet und anschließend behandelt worden, empfiehlt es sich, einen Kontrolltest durchzuführen, um den Behandlungserfolg zu überprüfen. Das macht aber nur dann Sinn, wenn die Zellen schon einige Zeit (je länger, desto besser) ohne Zusatz von Antibiotika im Medium kultiviert wurden.
Nach dem Absetzen der Antibiotika könnten sich einige Zeit später möglicherweise resistent gewordene Mycoplasmen wieder vermehren. Wenn diese dann die Kultur überwachsen, werden die Anzeichen des Befalls erneut sichtbar. Falls das eintritt, hat man das Problem nur verschleppt, und immer wiederkehrende Infektionen sind die Folge. Von rhythmisch wiederkehrenden Kontaminationswellen ist mir schon aus verschiedenen Labors berichtet worden. Die ständige Kontrolle der sterilen Arbeitsweise einerseits und regelmässiges Testen der Kulturen andererseits sind erforderlich, um saubere Zellkulturen zu erhalten.
Ist erst einmal das oben beschriebene Phänomen eingetreten, hilft oft nur noch eine Rosskur. Doch welche Antibiotika sind für eine effektive Behandlung geeignet? Bei den Auswahlkriterien ist es sinnvoll, auf Toxizität, Induktion von Resistenzen und auch darauf zu achten, wie lange ein Antibiotikum unter Zellkulturbedingungen stabil bleibt. Manche Antibiotika müssen in hohen Dosen eingesetzt werden, was zu hohen Folgekosten führt. In der entsprechenden Fachliteratur findet man die nötigen Angaben über diverse Antibiotika meist in tabellarischer Form. Was am besten funktioniert, ist erfahrungsgemäß von Labor zu Labor verschieden und hängt sicher auch von den jeweiligen Rahmenbedingungen ab. Wir haben bei stark befallenen Kulturen mit Gentamycin in einer Konzentration von 50 µg/ml Medium während einer Behandlungsdauer von drei bis fünf Tagen gute Erfolge erzielt. Ich weiß aber von früheren Kollegen, die auf das Mycoplasma Removal Agent von ICN schwören. Zuverlässig und reproduzierbar waren sie innerhalb von wenigen Tagen das Problem los.
Apropos Flüssigstickstoff, das ist ein Thema für sich. Auf der Biotechnika hatte ich die Möglichkeit, mit mehreren Firmenvertretern über das Mycoplasmenproblem zu sprechen. Die ganze Angelegenheit wurde kontrovers diskutiert. Von den einen habe ich gehört, dass sich Mycoplasmen sogar in Flüssigstickstoff vermehren sollen. Überleben okay, ihre Vermehrung unter diesen Bedingungen wurde allerdings an anderer Stelle angezweifelt. Fest steht jedenfalls, dass man sich die Mycoplasmen über den Stickstoff einhandeln kann. Das funktioniert über das Eindringen des Stickstoffs in die Kryoröhrchen. Die Tipps der Fachleute dazu lauteten, das Volumen der einzufrierenden Zellsuspension bis zum Eichstrich des Röhrchens aufzufüllen. Dadurch würde die Neigung des Stickstoffs, in das Kryoröhrchen einzudringen, verringert. Dabei muss aber erwähnt werden, dass man wiederum nicht zuviel Volumen hineingeben darf. Beim Auftauen nämlich hat der Stickstoff die umgekehrte Neigung, aufgrund des Druckunterschiedes möglichst schnell das Kryoröhrchen wieder zu verlassen. Man stelle sich einmal durch explodierende Röhrchen traumatisierte Mitarbeiter vor - also Vorsicht!
Dauerproblem Kryoröhrchen
Kryoröhrchen gibt es in unterschiedlichen Ausführungen, nämlich mit Innen- und mit Aussengewinde. Letztere sollen besser gegen Mycoplasmen schützen, weil sie zwei Dichtungen haben. Wieder daheim, haben wir das wir natürlich sofort ausprobiert, denn Zellen einzufrieren und wieder aufzutauen gehörte inzwischen zu unseren Lieblingsbeschäftigungen. Einen eklatanten Unterschied in der Effektivität bei der Mycoplasmenabwehr konnten wir allerdings nicht feststellen. Bei beiden Varianten hatten wir nach dem Auftauen wieder einen schwachen Befall zu beklagen. Routinemässig werden bei uns Kryoröhrchen auch noch in einen CryoFlex-Schlauch (Hersteller: Nunc), auch Schrumpfschlauch genannt, einzeln eingeschweisst. Aber auch das scheint kein effektiver Schutz zu sein, allenfalls stellt es eine mechanische Barriere dar.
Das einzige, was in solchen Krisensituationen helfen kann, ist eine flächendeckende Beseitigung aller möglichen Kontaminationsquellen. Angefangen von der Reinigung der verwendeten Kryobehälter und aller anderen Geräte, die in der Zellkultur benutzt werden, über die ständige Kontrolle der Sterilität, bis zum Einsatz von Antibiotika (die aber nur bei Bedarf in das Medium gegeben und nicht dauerhaft verwendet werden sollten, um unsauberes Arbeiten nicht zu verschleiern).
Aber Hand auf´s Herz - wer macht das alles schon mit dieser Konsequenz? Und selbst wenn man alles so korrekt machen würde wie es verlangt wird - wer garantiert, dass nicht wieder mit der nächsten Ladung Flüssigstickstoff das ganze Theater von vorne beginnt? Am Ende war es gar nicht der eigene Kryobehälter, sondern der Stickstofflieferant?! Während unser einer schwer ins Grübeln kommt, lachen sich die Mycoplasmen vermutlich ins Fäustchen. Das tun sie wahrscheinlich immer noch, wenn wir schon lange nicht mehr da sind.
Wer ähnliche Erfahrungen mit diesen oder anderen Plagen der Zellkultur gemacht hat, kann mir übrigens gerne per E-Mail (Sabine.Pils@strz.uni-giessen.de) darüber berichten. Demnächst mehr über andere Kontaminationen. Es gibt noch viele weitere Teufelchen, die in der Zellkultur ihr Unwesen treiben.
Methoden für den Mycoplasmennachweis
DAPI-Test zum Nachweis von Mycoplasmen-DNS:
Der DAPI-Test ist einfach durchzuführen, erfordert aber für die Auswertung ein Fluoreszenzmikroskop mit UV-Anregung. Der Test wird auf speziellen Falcon-Objektträgern (beispielsweise von Becton-Dickinson) mit einem Kammeraufsatz durchgeführt. In diesen Kammern wird je ein Tropfen der zu testenden, adhärenten Zellsuspension in 1 ml Medium über Nacht kultiviert.
Am nächsten Tag dekantiert man das Medium und verfährt wie folgt:
- 1x waschen mit 1 ml PBS pro Kammer für ca. 10 min, dann Lösung dekantieren.
- 1x fixieren mit 1 ml eiskaltem Methanol für 10 min, dann dekantieren und Objektträger an der Luft trocknen lassen; Kammeraufsatz entfernen.
- Objektträger mit einem Mounting Medium plus DAPI (Exitation > 360 nm, Emission > 460 nm) in einer Konzentration von 1-1,5 µg/ml eindeckeln.
- Beurteilung am Fluoreszenzmikroskop. Diese ist nicht so einfach und erfordert daher etwas Erfahrung. Wer sich nicht ganz sicher ist, sollte eine PCR durchführen.
Nachweis von Mycoplasmen mittels PCR:
PCR-Kits werden mittlerweile von vielen verschiedenen Firmen angeboten und liefern gut reproduzierbare Ergebnisse bei höherer Empfindlichkeit, verglichen mit dem DAPI-Test.
Die PCR-Detektion beruht auf der Amplifikation einer hoch konservierten Region der 16s rRNA im Mycoplasmen-Genom. Das spezifische PCR-Produkt hat eine Grösse von 270 bp und wird im Agarosegel sichtbar gemacht. Die interne Kontrolle zeigt an, ob die Amplifikation erfolgreich war, Positiv- und Negativkontrolle erleichtern die Interpretation der Ergebnisse.
Wenn man nicht nur wissen will, ob eine Kontamination vorliegt oder nicht, kann man durch einen SAU3A-Verdau zusätzlich die Mycoplasmenart bestimmen. Die häufigsten Arten lassen sich durch typische Fragmentmuster auf dem Gel identifizieren. Mycoplasma orale z.B. hat zwei charakteristische Restriktionsfragmente, eins ist 610 bp, das andere 265 bp lang.
Pech hat man, wenn keine der angegebenen Fragmentkombinationen mit der auf dem eigenen Gel übereinstimmt. Auf Nachfrage bei der entsprechenden Firma erfährt man, welche Arten nach dem Verdau zusätzlich nachgewiesen werden, aber nicht im Protokoll stehen. Angaben zu spezifischen Fragmentgrößen für diese Arten können dann aber meist nicht gemacht werden. In diesem Fall darf man sich rühmen, von einer ungewöhnlichen Spezies heimgesucht worden zu sein, und muss sich mit diesem Wissen begnügen.
Letzte Änderungen: 08.09.2004