Genauer zielen, besser schreiben
Spezial: Gene Editing
Mario Rembold
Per Gene Editing in der DNA herumschreiben wie in einem Textdokument – glaubt man diversen Medien, scheint die Sache kinderleicht. Im echten Forscherleben gibt es hierbei allerdings noch immer zahlreiche Stolpersteine. Dennoch ist mit CRISPR und Co. heute eine Menge möglich, wovon Genetiker vor 15 Jahren nicht mal zu träumen gewagt hätten. Und es wird stetig mehr...
Es beginnt mit einem zielsicher gesetzten Schnitt im Genom durch eine Nuklease. Anschließend repariert die Zelle den Doppelstrangbruch wieder. Dabei können zufällige Mutationen entstehen, oder die Zelle baut von außen zugegebene Fremd-DNA zwischen die Schnittstellen ein. So der grobe Ablauf bei den meisten Gene-Editing-Methoden.
Der besondere Kniff im ersten Schritt besteht darin, den Ort des Doppelstrangbruchs genau festzulegen – sodass die Nuklease also nicht bloß nach dem Zufallsprinzip schneidet. Transcription Activator-like Effector Nucleases (TALENs) und Zinkfinger-Nukleasen finden ihr Ziel über spezifische Wechselwirkungen zwischen Protein und DNA (siehe LJ 5/2014: 36-38). Im Jahr 2012 stellten Jennifer Doudna und Emmanuelle Charpentier dann die Methode vor, die heute fast immer in einem Atemzug mit „Gene Editing“ genannt wird: CRISPR/Cas9 (Science 337: 816-21).
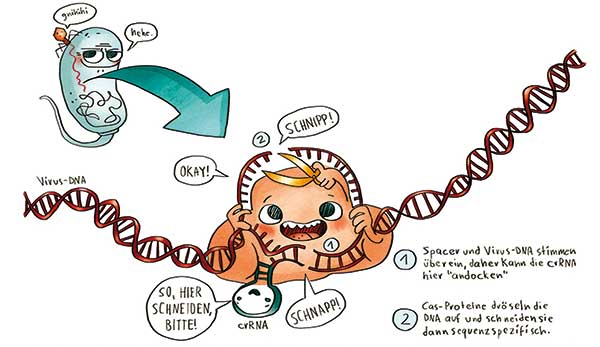
Hinter CRISPR und Cas steckt eigentlich ein prokaryotisches Abwehrsystem gegen virale Eindringlinge, um deren Erbgut spezifisch zu erkennen, zu zerschneiden und damit unschädlich zu machen (siehe „Stichwort des Monats“ LJ 12/2012). Die von Charpentier und Co. für die Molekularbiologie adaptierte Version braucht zwei Komponenten: Eine Leit-RNA oder sgRNA (für single guide RNA), die am 5’-Ende mit zwanzig frei wählbaren Basen beginnt. Diese Basenfolge muss komplementär zur Zielsequenz im Genom sein. Besagten Abschnitt auf der sgRNA nennt man auch Spacer, während man das Ziel auf der DNA als Protospacer bezeichnet (Im Prokaryoten-Genom liegen die Spacer innerhalb der namensgebenden „Clustered Regularly Interspaced Short Palindromic Repeats“, also der CRISPR).
Zielen per Basenpaarung
Am 3’-Ende der Spacer-Basen besteht die sgRNA aus einer konstanten Sequenz, deren chemische Eigenschaften für die Bindung an die Nuklease mit dem Namen CRISPR-assoziiertes (Cas) Protein verantwortlich sind. In der Molekularbiologie kommt häufig ein Cas9 aus Streptokokken zum Einsatz. Die Cas9-Schere kann nur dort an die DNA binden und schneiden, wo eine zu den ersten zwanzig sgRNA-Basen komplementäre Sequenz liegt. Ähnlich wie bei einer PCR muss man also nur die richtige Basenfolge festlegen, um sein Ziel auf der DNA anzusteuern. Und Oligonukleotide lassen sich heute leicht und kostengünstig herstellen.
Wichtig zu wissen ist noch, dass eine Cas-Nuklease nur schneidet, wenn auf die Erkennungssequenz der Ziel-DNA, also auf den Protospacer, ein spezielles Motiv folgt – das Protospacer adjacent motif oder PAM. Streptokokken-Cas9 verlangt beispielsweise zwei Guanine, die auf eine beliebige erste Base folgen (NGG). Der Schnitt erfolgt dann nahe des PAM innerhalb des Protospacers. Wer eine geeignete sgRNA designt, muss also sicherstellen, dass im Zielgenom an dieser Stelle auch ein PAM vorhanden ist. Klingt nach einer Einschränkung, hat aber den Vorteil, dass man in seinem Modellorganismus zusammen mit dem Cas9-Gen auch die sgRNA-Sequenzen im Genom platzieren kann, ohne dass diese herausgeschnitten werden (ihnen fehlt ja das PAM).
Mehrfachtreffer möglich
CRISPR/Cas9 ist als Werkzeugkasten vielseitig einsetzbar. Pflanzengenetiker bringen die zugehörigen Gene gern ins Pflanzengenom ein und entfernen die Kassette nach erfolgreichem Editieren wieder durch Auskreuzen und Selektieren. Mausforscher hingegen injizieren Nuklease-Protein und sgRNA häufig direkt in die Zygote, sodass die Genschere unmittelbar und nur für kurze Zeit aktiv ist. Wie man CRISPR/Cas9 konkret einsetzt, hängt immer von den Anforderungen an den Organismus und der spezifischen Fragestellung ab.
In jedem Fall aber steht und fällt das perfekte Gene Editing mit dem Design der sgRNA. Nur mit eindeutiger Sequenz kann man die DNA zielgenau treffen und unerwünschte Off-Target-Effekte anderswo im Genom vermeiden. Auf den ersten Blick scheinen Sorgen fehl am Platz, wenn man zwanzig Basenpositionen für die Spezifität zur Verfügung hat: Die Wahrscheinlichkeit für eine zufällige Übereinstimmung mit einer anderen 20-Basen-Region errechnet sich aus den 420 Möglichkeiten für solch eine Basenfolge – man kommt auf astronomisch geringe Eins zu einer Billionen. Innerhalb eines menschlichen Genoms mit „nur“ rund drei Milliarden Basenpaaren scheint das Risiko eines Zufallstreffers also gering.
Jedoch steckt in den Annahmen zur obigen Rechnung ein Denkfehler: Genome bestehen ja nicht bloß aus Zufallssequenzen, sondern zahlreiche Abschnitte sind evolutionär aus Duplikationen hervorgegangen. So stößt man auf diverse repetitive Regionen, und auch bei den proteinkodierenden Sequenzen ist Vorsicht geboten, wenn hochkonservierte Domänen innerhalb von Proteinfamilien hohe Übereinstimmungen zeigen. Es reicht also nicht, blind zwanzig beliebige Basen seines Zielgens herauszupicken, denen ein PAM folgt.
Trügerische Rechnung
Und es kommt noch schlimmer: „Cas9 braucht gar keine perfekte Übereinstimmung, um zu schneiden“, verrät Robin Graf, Doktorand in der Arbeitsgruppe von Klaus Rajewsky am Berliner Max-Delbrück-Centrum für Molekulare Medizin. „Manche Fehlpaarungen führen zu sogenannten Wobble Matches, die von Cas9 besonders gut toleriert werden“, erklärt Graf. „Außerdem toleriert Cas9 Sequenzabweichungen am Beginn der sgRNA viel besser als am Ende der Zielsequenz nahe des PAM.“
So bleiben unter dem Strich deutlich weniger als zwanzig Basen, auf die man sich in Sachen Spezifität wirklich verlassen kann. Man muss also bei ähnlichen Sequenzen im Genom mit Off-Target-Effekten und unerwünschten Schnitten rechnen. Auf solche möglichen ungewollten Ziele hin gilt es, das Genom zuvor zu untersuchen. Dabei kann eine sgRNA, die in einer Maus spezifisch genug ist, in menschlichen Zellkulturen zu falschen Treffern führen – und umgekehrt.
Außerdem weist Graf darauf hin, dass RNA zum Ausbilden von Sekundärstrukturen neigt. Eine der Basenfolge nach eindeutige Sequenz könnte chemisch zu Problemen führen, wenn sich die sgRNA so verformt, dass die Nuklease nicht mehr an die DNA herankommt oder gar nicht erst an die sgRNA bindet. „Die sgRNA sollte einen ausgeglichenen Anteil an Nukleotiden haben“, nennt Graf einen wichtigen Aspekt, um unerwünschte Schlaufen und Knoten der Leit-RNA zu vermeiden. Ähnliche Regeln kennt man vom Primer-Design für die PCR.
Bei vielen Gene-Editing-Versuchen möchte man ein Gen ausschalten oder zumindest dafür sorgen, dass das Genprodukt nicht mehr funktionsfähig ist. Dabei spekuliert der Experimentator darauf, dass bei Reparatur des Cas9-Schnitts ein Fehler unterläuft und es zu einem Frameshift kommt; verrutscht das Leseraster um einen Wert, der nicht durch drei teilbar ist, werden bei der Proteinsynthese hinter der Mutation nur noch falsche Aminosäuren angehängt, sofern die Translation nicht sogar komplett abbricht.
Wo setze ich die Mutation?
„Deshalb ist es sinnvoll, eine Mutation möglichst weit vorne im Protein zu erzeugen – und nicht erst irgendwo am Ende der Aminosäurefolge“, resümiert Graf. Andernfalls erhält man womöglich ein Genprodukt, das noch immer über funktionsfähige Domänen verfügt. Außerdem sei die Wahl des richtigen Exons wichtig, ergänzt er – und nennt ein hypothetisches Beispiel: „Wenn Exon 3 des Proteins gar nicht von allen Splice-Varianten des Genprodukts genutzt wird, hat man unter Umständen noch Restaktivität“. Im Idealfall wird man die Mutation also in einem Exon erzeugen, das in allen Varianten des Proteins vorkommt.
Off-Target-Effekte, Sekundärstrukturen und dann noch die richtige Position im Gen ansteuern – auch wenn man die grundlegenden Regeln für jedes Einzelproblem kennt, ist es extrem aufwändig, alle Parameter bei einem sgRNA-Design „von Hand“ zu berücksichtigen. Daher gibt es in den letzten Jahren immer mehr Software-Helferlein, die beim Basteln der sgRNA unter die Arme greifen. Auch Robin Graf war an der Entwicklung solch eines Programms beteiligt. CrispRGold nennt sich der Algorithmus, den die Forscher vor rund einem Jahr in PNAS vorgestellt haben (113(44): 12514-19). „Das Tool behandelt die Spezifität mit höchster Priorität, filtert jedoch auch ineffiziente Kandidaten heraus“, so Graf über das Programm. Wer CrispRGold selbst testen will, kann online über eine Eingabemaske ein Gen oder eine Sequenz zum Ausknocken eingeben und zwischen den Organismen Maus, Mensch und C. elegans wählen. Anschließend errechnet CrispRGold geeignete sgRNA-Sequenzen (http://crisprgold.mdc-berlin.de/).
Forscher, die mit unsterblichen Zelllinien arbeiten, werden womöglich mit Off-Target-Effekten leben können. Man kann ja unter zahlreichen Klonen in aller Ruhe diejenigen herausselektieren, die eine Mutation an der richtigen Stelle tragen. Manchmal aber braucht man eine einzigartige sgRNA und muss sehr effizient schneiden – zum Beispiel bei Anwendungen im lebenden Organismus, oder wenn man mit aus Gewebe isolierten primären Zellen arbeitet, die sich nicht über lange Zeit kultivieren lassen. „Die sind oft viel näher an der Physiologie, und deswegen sind die Erkenntnisse aus solchen Experimenten sehr relevant“, meint Graf Wer solche sterblichen Zellen in Kultur hat, möchte daher sicher sein, dass CRISPR/Cas9 möglichst effizient das erwünschte Resultat bringt. In ihrem Paper haben Graf und seine Mitstreiter CrispRGold für das Design von sgRNAs genutzt, um Gene in isolierten Immunzellen auszuschalten. Für B-Zellen berichten die Autoren von einer durchschnittlichen Knockout-Effizienz von achtzig Prozent.
Auch aus der Schweiz gibt es Neuigkeiten in Sachen CRISPR/Cas9 und Bioinformatik. Rory Johnson forscht an der Uni Bern in einem Labor, das zum Swiss National Center of Competence in Research (NCCR) RNA & Disease gehört. Zusammen mit Kollegen aus Spanien hat er ein Software-Tool namens CRISPETa entwickelt und Anfang des Jahres vorgestellt (PLoS Comput Biol 13(3): e1005341). Auch diese Software ist als Web-Applikation für jeden zugänglich (http://crispeta.crg.eu/).
Die Tüftler um Johnson haben es auf nicht-proteinkodierende Regionen im Genom abgesehen. „Da gibt es einen fundamentalen Unterschied zu kodierenden Zielen“, erklärt Johnson, denn nicht-kodierende DNA hat kein Leseraster, das man unterbrechen kann. „Eine kleine Abweichung wird die Funktion dieser Sequenz wahrscheinlich nicht signifikant verändern.“ Daher ist CRISPETa darauf spezialisiert, Paare von sgRNAs zu designen, deren Protospacer die Zielsequenz flankieren. Dadurch kann die Cas9-Schere zwei Schnitte setzen und so auch größere Abschnitte aus dem Genom entfernen.
Hilfe vom Programmierer
Prinzipiell könne man natürlich auch andere Algorithmen verwenden, um passende sgRNAs für nicht kodierende Abschnitte zu finden, räumt Johnson ein. „CRISPETa ist aber speziell designt, um direkt Paare von sgRNAs zu liefern“, fährt er fort und verweist auf großangelegte Deletions-Projekte mit Bibliotheken, in denen zehntausende von Zielen herausgeschnitten werden sollen. Da sei eine speziell darauf optimierte Software viel praktikabler.
Was kommt nach dem Schnitt?
Was die Off-Target-Effekte durch Fehlpaarungen betrifft, gibt es auch Cas9-Nukleasen, die weniger fehlertolerant sind. So etwa Cas9 aus Francisella novicida, mit der Fuqiang Chen et al. für die Firma Merck experimentiert haben und in einer aktuellen Publikation darüber berichten (Nat Commun 8: 14958). Die Autoren rufen in Erinnerung, dass die Cas-Nukleasen evolutionär nicht auf Eukaryoten optimiert sind, und so arbeite das weniger fehlertolerante Francisella-Cas9 zwar im Reagenzglas zuverlässig, komme aber in vivo nicht gut durch das Chromatin hindurch. Daher haben sie gleichzeitig ein inaktives Streptokokken-Cas9 in die Nachbarschaft des eigentlichen Ziels im Genom gelotst. Dieses modifizierte Cas9 bindet zwar, schneidet aber nicht. Dafür öffnet es anscheinend das Chromatin für die Francisella-Nuklease, die dadurch häufiger ihr Ziel auf der DNA erreicht und dort schneidet. Die Autoren schreiben, dass inaktives Streptokokken-Cas9 und aktives Francisella-Cas9 gemeinsam zuverlässiger arbeiten als jedes einzelne Protein allein. Proxy-CRISPR nennt Merck diesen Kniff und hat hierfür laut Pressemitteilung schon Patentanträge gestellt.
Optimierte Cas-Proteine und clevere Algorithmen erlauben also, immer zielgenauer an die DNA heranzukommen. Bei aller Euphorie sei aber erwähnt, dass man hierbei ja nur den ersten Schritt des Gene Editings verbessert. „Wenn wir das mit Text-Editing vergleichen, ist das so, als hätten wir in unserem Textverarbeitungsprogramm gerade mal herausgefunden, wie man den Cursor setzt“, bringt es Molekularbiologe Ralf Kühn auf den Punkt. Kühn leitet die Transgene Core Facility am Max-Delbrück-Centrum in Berlin. Für Arbeitsgruppen am Institut stellen er und sein Team genetisch veränderte Mäuse her – und dabei kommt Kühn natürlich nicht mehr um CRISPR/Cas9 herum.
So sicher man die Nuklease zu ihrem Ziel auf der DNA lotsen kann, umso mehr ist man nach dem Schnitt dem Zufall überlassen. Für Doppelstrangbrüche dominiert in den meisten Zellzyklusphasen ein Reparaturmechanismus, der lose Enden einfach wieder zusammenknüpft. Non-homologous end joining (NHEJ) nennt sich dieser Prozess. Dabei entstehen gelegentlich Fehler – einzelne Basen gehen verloren oder werden zu viel eingebaut. Durch diese Indels, also kleine Deletionen oder Insertionen, kann sich das Leseraster verschieben – und genau darauf setzen Forscher, die ein Gen abschalten wollen.
Reparatur lenken
Schwieriger wird es, wenn bei der Reparatur ein neues Stück DNA zwischen den losen Enden eingefügt werden soll. „Das wäre das eigentliche Ziel, denn wir wollen den Text im Genom ja auch gezielt um- oder neu schreiben können“, meint Kühn. Zum Beispiel, um einem Protein eine zusätzliche Domäne zuzufügen oder ein komplettes Gen gezielt in ein bestimmtes Cluster einzusetzen. Für solche Knock-Ins macht man sich einen anderen Reparaturmechanismus zunutze: die Homologie-gerichtete Reparatur (homology-directed repair, HDR). Als Template dient normalerweise der homologe Abschnitt auf dem Schwesterchromatid. Bietet man der Zelle stattdessen ein Plasmid an, das ein Insert trägt, an dessen Flanken jenseits der Schnittstellen homologe Sequenzen liegen, dann wird in einigen Fällen anstelle des Schwesterchromatids dieses Plasmid als Kopiervorlage genutzt. Die Zelle baut also die Sequenz des Inserts bei der Reparatur des Doppelstrangbruchs ein. Theoretisch eine sichere Sache, denn Cas9 findet ja solange ein Ziel zum Schneiden, bis auf beiden Chromosomen das Insert hineinkopiert wurde. In der Praxis nicht ganz so einfach, weiß Kühn: „Wir sind froh, wenn es überhaupt in einen Lokus reingeht“, so seine Erfahrungen mit Säugerzellen.
Ohnehin ist HDR meist inaktiv, außer in mitotisch aktiven Zellen während der S- und G2-Phase. Nur dann kann die Zelle Doppelstrangbrüche in nennenswertem Umfang über homologe Rekombination ausbessern. Wer etwa im Rahmen einer Gentherapie Inserts in Zellen einbringen will, die sich nicht mehr teilen, kommt auf diesem Weg nicht weiter. Kühns Team wollte jedoch Zellen dazu bringen, statt NHEJ den HDR-Weg zum Flicken von Doppelstrangbrüchen zu wählen, um so über CRISPR/Cas9 gezielt Inserts einzubringen.
Und tatsächlich fanden die Berliner 2015 zusammen mit Kollegen aus München in menschlichen Human Embryonic Kidney (HEK)-Zellen einen Weg, die Reparatur-Regulation in Richtung HDR zu lenken (Nat Biotechnol 33(5): 543-8). Um die Häufigkeiten von NHEJ und HDR miteinander vergleichen zu können, verwendeten Kühn und Co. ein cleveres Reportersystem und modifizierten die HEK-Zellen zuvor folgendermaßen: Hinter der CRISPR/Cas9-Zielsequenz im Genom lag eine kodierende Sequenz für ein rot-fluoreszierendes Protein. Allerdings war das Leseraster verschoben, so dass kein funktionsfähiges Genprodukt entstand. Auf Höhe der Schnittstelle wiederum befand sich eine kodierende Sequenz für ein grün fluoreszierendes Venus-Protein; die lag zwar korrekt im Leseraster, allerdings fehlte ein Fragment. Traffic Light Reporter (TLR) nennt sich dieses Konstrukt.
Außerdem bekamen die HEK-Zellen einen Expressionsvektor für Cas9, ausgestattet mit der passenden sgRNA gegen den TLR. Weiterhin gaben die Forscher ein Donor-Plasmid mit dem fehlenden Fragment der Venus-Sequenz hinzu. Eine für TLR heterozygote Zelle, die den Cas9-Schnitt über HDR repariert, würde dabei auch ihr Venus-Gen anhand der Vorlage auf dem Plasmid korrigieren und anschließend grün leuchten. Sollte die Zelle hingegen auf NHEJ zurückgreifen, würde statistisch in einem Drittel der Fälle das Leseraster so verändert, dass sie anschließend rot fluoreszierten. TLR erlaubt somit also, das Verhältnis zwischen NHEJ und HDR zu quantifizieren.
Am frühen Schalter ansetzen
Die Forscher hatten damals verschiedene Wege getestet, um in die Regulation der Zellreparatur einzugreifen. Vielversprechend schien ein kleines Molekül namens SCR7, das die Ligase IV inhibiert – jenes Enzym, das beim NHEJ die losen Enden verknüpft. „Leider ist dieses Rezept nicht auf Maus-Zygoten und menschliche induzierte pluripotente Stammzellen (iPS)-Zellen übertragbar“, berichtet Kühn über spätere Experimente mit SCR7. Die HEK-Zelllinie scheint hier ein Sonderfall gewesen zu sein.
Kühn vermutet, dass man mit der Ligase IV zu spät im Signalweg der DNA-Reparatur ansetzt. „Wir müssen zum Schlüsselprotein gelangen, zu dem Kippschalter, der die Entscheidung entweder in Richtung HDR oder in Richtung NHEJ lenkt“. Denn offenbar hat eine Säugerzelle sich schon gegen HDR entschieden, wenn die Ligase IV rekrutiert wird. Blockiert man das Enzym, hemmt man zwar NHEJ, fördert aber nicht HDR.
Heute experimentieren Kühn und Kollegen mit einem künstlichen Peptid namens i53. Dieses inhibiert das zelluläre 53BP1-Protein. „53BP1 ist der Entscheider“, so Kühn. „Gewinnt dieses Schlüsselprotein die Oberhand an einem Doppelstrangbruch, geht die Reparatur in Richtung NHEJ.“ Demnach lenkt man die Reparatur mittels i53 in Richtung HDR. Erste Ergebnisse aus HEK- und iPS-Zellen seien vielversprechend und Experimente an Mauszygoten in Planung, verrät Kühn.
Vielleicht brauche man irgendwann die lästige HDR-Methode gar nicht mehr, hofft Kühn – und verweist auf Ergebnisse eines Teams um Juan Izpisua Belmonte vom Salk-Institut in Kalifornien. In einer Arbeit vom letzten Dezember berichtet die Gruppe über ihre Homology-independent targeted integration (HITI): Nach dem Cas9-Schnitt setzt die NHEJ-Reparatur ein Insert zwischen beide Schnittstellen (Nature 540: 144-49). Eigentlich eine naheliegende Idee – denn weil sich NHEJ ohnehin nicht um Homologie schert, sollte man über diesen Weg auch Fremd-DNA ins Genom hineinligieren können. Allerdings sei es nicht effizient, einfach nur ein lineares Stück DNA in die Zelle zu injizieren, erklärt Erstautor Keiichiro Suzuki. „Der Trick des HITI-Systems ist, dass Genom und Donor zur selben Zeit geschnitten werden.“
Knock-ins ohne Zellteilung
Gute Ergebnisse brachte ein zirkuläres Plasmid, das nur die gewünschte Spender-DNA enthält wie auch die passende sgRNA-Zielsequenz gefolgt von einem PAM. Erst wenn Cas9 aktiv ist, wird auch das Plasmid geschnitten und somit linearisiert. Damit bestimmt man sogar eine favorisierte Richtung, denn wird das Insert „falsch herum“ eingesetzt, entstehen wieder zwei neue Cas9-Ziele; nur in einer Ausrichtung liegen an der einen Ligationsstelle beide PAMs sowie an der anderen beide Protospacer beieinander, sodass Cas9 an der einen Seite nicht mehr binden und an der anderen nicht mehr schneiden kann.
Sogar Neuronen im Rattengehirn konnten Suzuki et al. mit HITI editieren – also Zellen, die keine Mitose mehr durchlaufen. Ebenso versuchte das Team, Ratten mit Retinitis pigmentosa per Gen-Reparatur zu heilen. Drei Wochen alten Tieren injizierten sie entsprechende Vektoren ins Auge – und immerhin war die Mutation später in einigen Zellen behoben, auch wenn die Tiere dadurch nicht geheilt waren. „Wir hatten eine Knock-in-Effizienz von drei bis zehn Prozent“, fasst Suzuki diesen Teil der Ergebnisse zusammen. „Leider immer noch zu gering, um bei den meisten Krankheiten einen wirklichen Heileffekt zu erzielen.“
Rund um CRISPR/Cas9 gibt es also weiterhin noch eine Menge zu optimieren, gerade wenn man an Gentherapien am Menschen denkt. Dennoch kann man bei allen Hürden, die noch warten, bereits festhalten: Die Werkzeuge, um die DNA zielgerichtet zu verändern, werden gerade immer schneller immer besser.
Letzte Änderungen: 14.09.2017