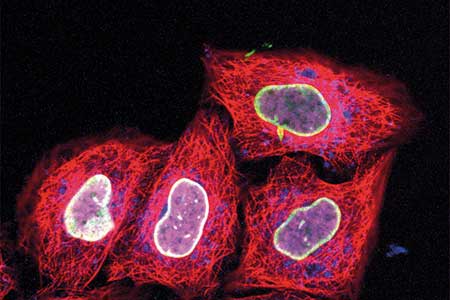
Molekulare Leuchttürme
Einblick in Zellen mit neuen Fluoreszenz-Sonden
Andrea Pitzschke
Moderne Mikroskope erkennen immer feinere Details der Zelle. Ohne leuchtende Fluoreszenzmarker würden aber auch sie im Dunkeln tappen.
Die zelluläre Bildgebung ermöglicht, biologische Prozesse visuell auf Zellebene, zu verfolgen. Anders als bei biochemischen Ansätzen, welche durch rabiate Extraktionsverfahren Zellen in ihre Bestandteile zerlegen, gilt für die zelluläre Bildgebung vor allem eines: Die Zellen möglichst wenig zu stören. Die Herausforderung liegt darin, eine hohe Signalspezifität und -schärfe vor einem sauberen Hintergrund zu erhalten.
Gängige Verfahren setzen hierzu auf Farbstoff-markierte Antikörper. Ihr Vorteil: Sie erkennen spezifische Zielmoleküle (meist ein Protein). Ihr Handicap, abgesehen von Kosten- und Zeitaufwand: Antikörper sind selbst große Proteine, entsprechend unscharf ist die Signalwolke, die sie umgibt.
Alternativ lassen sich signalliefernde Fluoreszenzfarbstoffe über ein Anhängsel (Tag) an das zu untersuchende Protein anbringen. Dies geschieht meist durch Expression entsprechender Fusionsproteine in genetisch manipulierten Zellen.
Dicker Brocken
Der Klassiker unter den Fluoreszenz-Tags ist das Grünfluoreszierende Protein (GFP). Dank Aminosäureaustausch an einzelnen kritischen Positionen existiert eine große Palette an GFP-Varianten, die zum Beispiel andersfarbig leuchten, stabiler oder Redox-sensitiv sind. Bei allen gilt aber: Der Tag ist mit 27 kDa ein ziemlich großer Brocken. Hängt er am Protein, das man studieren will, beeinträchtigt er unter Umständen dessen Lokalisation, Bindefähigkeit, Enzymaktivität oder Funktionalität.
Markierungsstrategien erlauben, ein Zielmolekül im zellulären Sammelsurium zu erkennen und seine Lokalisation und Transportroute aufzudecken. Als Markierung dienen Farbstoffe, die direkt oder indirekt an das Zielmolekül geknüpft und vornehmlich mit Hilfe der Fluoreszenz-Mikroskopie visualisiert werden.
Das Kuppeln geht auf dreierlei Wegen: mit Enzymen, Metallionen oder kleinen Molekülen sowie über Peptid-Peptid-Interaktionen. Der Knackpunkt bei allen drei Strategien liegt darin, dass die Reaktionen bioorthogonal verlaufen, die zellulären Prozesse also nicht stören. Im Idealfall reagieren die Reaktanten nicht mit Komponenten der Zelle, sondern nur untereinander. Meist kombiniert man hierzu eine metabolische Umwandlung mit einer anschließenden selektiven Reaktion.
Fluoreszierendes Kuckucksei
Der anzubringende Farbstoff muss biokompatibel und ungiftig sein – aber dennoch stabil genug, um nicht gleich verstoffwechselt zu werden. Außerdem sollte die in lebenden Systemen stattfindende Markierungsreaktion möglichst schnell und irreversibel verlaufen. Die Zellmaschinerie arbeitet dabei mit und bemerkt im Idealfall gar nicht, dass ihr ein fremdes Molekül als Kuckucksei untergejubelt wird.
Einige Enzyme übertragen funktionelle Gruppen, etwa Fluorophore, selektiv auf Substrate, zum Beispiel auf ausgesuchte Aminosäuren in Zielproteinen. Dieses muss aber ein entsprechendes, sterisch zugängliches Erkennungsmotiv enthalten. Ebenso wichtig ist, vorab zu klären, ob und in wie vielen weiteren Proteinen dieses Motiv im untersuchten System vorkommt. Je länger die Sequenz, desto geringer ist die Gefahr ungewollter Konkurrenz. Andererseits sind längere Motive voluminöser.
Zur Auswahl stehen unter anderem Biotinligase, die den Acceptor Peptid (AP)-Tag erkennt, sowie Liponsäure-Ligase die auf den Liponsäure Acceptor Peptid (LAP)-Tag anspricht. Auch einige Transglutaminasen sind in der Lage, bestimmte Hexa- oder Heptapeptide entsprechend zu bearbeiten. Die Peptide kommen im Zielprotein entweder ohnehin vor oder werden als Tag im Fusionsprotein untergebracht, wahlweise terminal oder intern.
Zweistufige Markierung
Oft ist die Enzym-vermittelte Markierung die erste Stufe in einem zweistufigen-Verfahren. Die Enzyme bringen zunächst eine kleine chemische Gruppe am Zielprotein an. Im zweiten Schritt spürt ein fluoreszierendes Affinitäts-Label diese Gruppe auf und macht sie sichtbar.
Im Fall der Biotinligase versieht man Biotin zunächst mit einem AP-Tag. Fluoreszenzfarbstoff-konjugiertes Streptavidin fungiert anschließend als Reporter. Liponsäure-Ligase und Transglutaminasen schaffen die Markierung auch einstufig, hier fungiert die angebrachte chemische Gruppe selbst als Leuchtsignal.
Transpeptidasen bewerkstelligen die Markierung generell in nur einem Schritt. Die Transpeptidase Sortase A aus Staphylococcus aureus entfernt zum Beispiel in Zielproteinen Glycin aus dem C-terminalen Motiv LPXTG und ersetzt es durch eine Fluorophor-gekoppelte Oligo-Glycin-Kette.
Die Enzym-vermittelte Markierung punktet vor allem mit kurzen Tags, die dennoch spezifisch sind. Allerdings dauert die enzymatische Reaktion meist einige Stunden. Zudem sind relativ hohe Mengen an Substrat nötig, die wiederum zelluläre Prozesse beeinflussen können. Manche Reaktionen sind reversibel, die angebrachte Markierung ist somit nicht beständig.
Die Metallionen-vermittelte Markierung basiert, salopp formuliert, auf Elektronen-Sharing. Bei diesem finden Moleküle mit Elektronenüberschuss (Zielprotein) und -defizit (fluorezenzmarkierte Metallionen) zueinander. Wie kommt der Elektronenüberschuss zustande? Beispielsweise durch Einfügen eines Cystein-reichen Peptids, meist CCGPCC. Thioester von Arsenverbindungen gehen kovalente Bindungen mit den freien Thiolgruppen der Cysteine ein. Aktuelles Highlight sind sogenannte Fluorescein-Arsenical-Helix Binder (FlAsHs), die in punkto Leuchtkraft ihre Vorgängervarianten um das Zigtausendfache übertreffen. Auch wenn hierbei Konzentrationen im unteren Mikromolar-Bereich genügen, sollte man sich jedoch der hohen (Cyto-)Toxizität von Arsen-Verbindungen bewusst sein.
Die Risiken von Markierungen, die auf Cystein-Clustern beruhen, leuchten ein: Binden diese an die freien Thiolgruppen hindert dies Proteine daran, andere intra- oder intermolekulare Disulfidbrücken zu bilden. Das ist natürlich riskant, da diese unter Umständen für die Faltung, Funktionalität, Stabilität und/oder Lokalisation ausschlaggebend sein können. Zudem kann jedes x-beliebige Protein, das ein solches Motiv trägt (und das sind einige), ungewollt mitmarkiert werden.
Spezifischer sind Metall-chelatisierende Tags, da diese in der Natur kaum vorkommen. Ketten aus zehn Histidin-Perlen beispielsweise, die nicht-kovalente Komplexe mit fluoreszierenden Nickelderivaten bilden. Verglichen mit Nickel-, Kobalt-, und Zinkionen sind Lanthanidionen langlebiger und eignen sich zudem gut für die NMR. Der dazugehörige Lanthanid-Binding-Tag (LBT) aus einem empirisch optimierten 18-Aminosäure-Motiv aus Calmodulin wurde bisher nur für In-vitro-Markierungen verwendet. Prinzipiell spricht jedoch nichts dagegen, ihn auch in vivo einzusetzen (Franz et al., Chembiochem 4: 265-71).
Reißverschluss-Prinzip
Die dritte Kupplungs-Option kann man sich wie einen Reißverschluss vorstellen. Das Zielprotein trägt ein interaktionsfreudiges Motiv, etwa eine Coil-Struktur. Als Partner dient ein ebenso kontaktfreudiges Farbstoff-tragendes Peptid, das der Experimentator in die Zelle einschleust. Zielprotein und markiertes Peptid finden sich, und verschiedene intermolekulare, elektrostatische Wechselwirkungen sorgen dafür, dass der Reißverschluss hält.
Die meisten Markierungen durch Peptid-Protein-Interaktionen zielen auf den N-Terminus. So etwa der (EIAALEK)-3x-Tag, dessen negativ geladene Coil-Struktur sich an positiv geladene Farbstoff-markierte Coils aus (KIAALKE)-3x schmiegt. Diese nicht-kovalente Methode ist schnell und sparsam: 20 bis 60 Nanomol Farbstoffmoleküle und zwei Minuten Reaktionszeit genügen (Yano et al., ACS Chem Biol, 3, 341-5).
Es geht aber auch kovalent: An der Humboldt-Uni Berlin hat das Team um Oliver Seitz die sogenannte Peptid-Templated Acyl Transfer-Methode entwickelt, die auf der vorübergehenden Partnerschaft zwischen Zielprotein und Farbstofflieferant beruht ( Angew Chem Int Ed Engl 53: 10237-41). Über einen kurzen Tag von 22 Aminosäuren bildet das Zielprotein eine parallele Coiled-Coil-Struktur mit dem Donor-Peptid. Beim Kontakt kommt es zum Transfer eines (als Thioester gebundenen) Fluoreszenz-Farbstoffs vom Donor auf eine Cysteingruppe des Empfängers.
Farbstoff-Transfer
Das Verfahren liefert unter anderem bei der Lokalisation menschlicher Y2-Rezeptorproteine in lebenden Zellen brillante Ergebnisse. Die Entwickler der Technik setzen ihre Forschung inzwischen an der Uni Leipzig fort. Ihr jüngster Review-Artikel zu bioorthogonalen Markierungsmethoden ist wärmstens zu empfehlen (Lotze et al., Mol Biosyst 12: 1731-45).
Kurze Tags und hohe Spezifität schließen sich bei der Split-Intein-Strategie namens Traceless Tracing nicht aus, die Robert Tampés Gruppe an der Uni Frankfurt entwickelte (Braner et al., Chem Sci: 2646-52). Das Zielprotein trägt hier einen langen Tag, der spezifisch von einer passenden Farbstoff-markierten Peptid-Sonde erkannt wird. Tag und Peptid sind so konzipiert, dass sie aneinander binden, sich selbst als Intein herausschneiden und dabei das Farbstoff-Molekül am Zielprotein hinterlassen.
Ihre Biokompatibilität und geringe Größe machen insbesondere Azid-modifizierte Fluoreszenzmoleküle für die zelluläre Bildgebung attraktiv. Die Azidgruppe ist reaktionsfreudig und dennoch stabil. Verschiedene Fluoreszein- und Rhodamin-kombinierte Azide variieren in ihren spektroskopischen Eigenschaften. Um Autofluoreszenz-Überraschungen zu vermeiden, sollte man jedoch vorab prüfen, welche Wellenlängen diesbezüglich Probleme bereiten. Fluorophore, die im Rot- beziehungsweise Nah-Infrarot-Licht (NIR) emittieren, schneiden meist besser ab als blau-grün-emittierende. Mit entsprechenden Seitengruppen ausgestattet eignet sich zum Beispiel der NIR-Klassiker Cy5 zur Markierung von Glykanen die ein Azid-Anhängsel tragen. Cy5-Varianten punkten mit einer verbesserten Löslichkeit sowie unterschiedlichen Emissionsspektren (az-CyFur).
Auch Edward Lemkes Team vom Heidelberger EMBL tüftelt an der Entwicklung neuer Markierungsmethoden. Die Gruppe nutzt hierzu insbesondere eine klassische Reaktion aus der Klick-Chemie, die auf einer [4+2]-Diels-Alder-Cycloaddition beruht. Bei dieser sogenannten SPIEDAC-Reaktion reagieren unter Ringspannung stehende (gespannte) Dienophile, wie zum Beispiel Cyclooctin (SCO) oder trans-Cycloocten (TCO), mit Tetrazinen (Tet). Funktionalisiert man Proteine mit den entsprechenden Alkinen oder Alkenen, reagieren sie mit Tetrazin-modifizierten Fluoreszenzfarbstoffen und werden hierdurch markiert.Die Heidelberger testeten bei ihrem selektiv verbesserten SPIEDAC-Verfahren (seSPIEDAC) diverse Dienophile systematisch auf ihre Reaktionsfähigkeit mit unterschiedlich substituierten (H+, Me)-Tetrazin-Farbstoffen.
Hierbei stellten sie fest, dass H-Tet generell mit allen Dienophilen reagiert, Me-Tet jedoch nur mit TCOs. Mit entsprechenden H-Tet-Atto532 beziehungsweise Me-Tet-Cy5-Farbstoffen ist es deshalb möglich, SCO- und TCO-modifizierte Proteine parallel in derselben Zelle zu detektieren. Den visuellen Beweis hierzu liefern Lemke und Co. anhand zweifarbiger Pulse-Chase-Labelling-Experimente von Insulin-Rezeptoren (Nikic et al., Angew Chem 55: 16172-76).
Bleibt noch die Frage, wie SCO oder TCO überhaupt ins Zielmolekül gelangen. Auch hierfür hat Lemkes Team eine Lösung in Form von nicht-kanonischen Aminosäuren (UAAs) parat. Im Wettkampf um den kürzesten Tag sind UAAs nicht zu unterbieten. Das Zielprotein muss nur an einer einzigen Aminosäure manipuliert werden. Dies kann am C- oder N-Terminus oder im Inneren des Proteins sein. An die Stelle einer normalen Aminosäure tritt eine UAA mit einer „Antenne”, die mit entsprechenden Fluorophoren reagieren.
Unnatürliche Aminosäuren mit Antenne
Perfekte Antennen sind SCOs und TCOs, die sich als Teil unnatürlicher Aminosäuren im Zuge der Translation ins Zielprotein einbauen lassen (siehe hierzu auch Editorial 1130). Die Grundidee besteht darin, ein besonderes tRNA-tRNA-Synthetase-Paar in die Zellen einzuschleusen. Die tRNA ist so gezimmert, dass sie von der tRNA-Synthetase im Cytosol erkannt und von den Ribosomen akzeptiert wird. Im Zuge der Proteinsynthese wird hieraus schließlich ein Lysin-SOC oder Lyc-TOC. Versetzt man die Zellen anschließend mit einem Tetrazin-Farbstoff, so leuchten die markierten Zielproteine in den jeweiligen Farben.
Die UAA-basierte Markierung kämpft jedoch noch mit Kinderkrankheiten. Die größte Hürde besteht darin, die UAA in ausreichenden Mengen in die Zellen einzuschleusen und der zelleigenen Proteinsynthese-Maschinerie effizienter unterzumogeln. Schließlich konkurriert der UAA-Einbau ständig mit der Translations-Stopp-Maschinerie der Zelle. Auch hier gelang den Heidelbergern ein entscheidender Fortschritt. Der Gruppe fiel ein verstecktes Kernlokalisationssignal (NLS) in der tRNA-Synthetase auf, das sie gegen ein Kernexportsignal (NES) tauschten. Die tRNA-Synthetase landet hierdurch ausschließlich im Cytosol, wo sie für die ribosomale Proteinsynthese gebraucht wird. Prompt stieg die UAA-Einbau-Effizienz um das Fünfzehnfache an (Nikic et al., Angew Chem Int Ed Engl 55:16172-76).
Malen mit Click
Durch eine weitere Optimierung, die das Lemke-Team Click-Paint nennt, ist es mit der Methode möglich, einige wenige Dutzend Moleküle aufzuspüren. Die Technik ist hierdurch auch für die höchstauflösende Mikroskopie (Nanoskopie) geeignet. Mittels UAA-Strategie baut man im Zielprotein eine unnatürliche Aminosäure ein, die einen definierten Docking-DNA-Strang trägt. Der komplementäre Imaging-Strang ist mit einem Fluoreszenz-Farbstoff fusioniert. Formieren sich Docking- und Imaging-Strang zur Doppelhelix, leuchtet das Zielprotein. Die Vorteile dieser brandneuen Technik sind ihre absolute Biokompatibiliät sowie ihre hohe Spezifität und Sensibilität. Zudem erhöht sich durch das DNA-Anhängsel die Löslichkeit der Fluoreszenz-Farbstoffe.
Es geht aber auch andersherum: Die Gruppe des Koreanischen Biotechnologen Kyubong Jo konstruierte sogenannte Fluoreszenz-Protein-DNA-binde-Peptide (FP-DBPs) mit denen sich DNA verschiedenfarbig anmalen und in vivo orten lässt (RSC Adv: 46291-98). Die Wissenschaftler kreierten hierzu zwei Heptapeptide (KWKWKKA) und fusionierten diese mit GFP oder mCherry. Die Lysin-Reste der Peptide krallen sich die DNA-Phosphatgruppen, während sich Tryptophan zwischen die DNA-Basen schiebt (interkaliert).
Obwohl die DNA hierdurch nur Sequenz-unspezifisch markiert wird, hat die Strategie gegenüber konventionellen Fluorophoren wie Ethidiumbromid Vorteile: Die Bestrahlung mit UV-Licht führt hier nicht zum Strangbruch, die Peptide sind nicht-toxisch und bieten zudem eine bessere Auflösung.
Lee et al. zufolge sind in lebenden E.coli-Zellen unter dem Fluoreszenzmikroskop Muster zu erkennen, die von intensiv-leuchtenden Nukleotiden stammen. Aufgrund der Abhängigkeit der DNA-Peptid-Interaktion vom pH-Wert ist die Markierung reversibel und entsprechend manipulierbar. Zudem sind die FP-DPS-transformierten Zellen direkt aus der Kultur heraus bereit für die Mikroskopie – schließlich stellen sie den Farbstoff ja ständig selbst her.
Peptidsonden
Dass auch konventionelle Mikroskope beachtliche Einblicke in zelluläre Prozesse geben können, beweist ein Forscherteam um Markus Sauer vom Biozentrum Würzburg, Matthias Kneussel vom Zentrum für Molekulare Neurobiologie Hamburg (ZMNH) sowie Kristian Strømgaard von der Universität Kopenhagen. Die Gruppe entwickelte Peptidsonden, die ohne genetische Manipulation spezifisch an Zielproteine binden (Maric et al., Nature Chem Biol, 13(2): 153-60).
Das Prinzip ist im Grunde das Gleiche wie bei der Antigen-Antikörper-Erkennung. Durch ihre Kompaktheit liefern Peptidsonden jedoch wesentlich schärfere Signale (siehe hierzu auch das Interview mit Hans Michael Maric, dem Erstautor der Studie auf der gegenüberliegenden Seite).
Dass ihre Methode prinzipiell funktioniert, zeigen Maric et al. anhand der Visualisierung postsynaptischer Rezeptoren. GABA- und Glycin-Rezeptoren steuern die schnelle synaptische Inhibierung, ihre Störung verursacht unter anderem Epilepsie und Autismus. Gephyrin, als wesentlicher Bestandteil inhibierender Synapsen, interagiert direkt mit diesen Rezeptoren.
Super-bindende Peptide
Das deutsch-dänische Team nahm sich die intrazelluläre Domäne der Rezeptoren vor und identifizierte in dieser ein Konsensus-Peptid als vermeintliches Gephyrin-Interaktionsmotiv. Zwölf Positionen darin tauschte die Gruppe systematisch gegen alle zwanzig Aminosäuren aus.
Anschließend suchten die Wissenschaftler aus den 240 erhaltenen Kandidaten Peptide mit der höchsten Gephyrin-Bindefähigkeit aus. An diese Super-Binding-Peptide knüpften sie ein Arginin-Schwänzchen, um die Zellpermeabilität zu verbessern, sowie einen Fluoreszenzfarbstoff zur Detektion. Fertig war die Peptidsonde.
Dank der in Kopenhagen aufgebauten Technologie-Plattform sollte es künftig möglich sein, modifizierte Peptide im Mikrochip-Format parallel und effizient zu produzieren sowie ihre Affinität für das jeweilige Zielprotein zu testen.
Letzte Änderungen: 06.02.2017