Superschnelle Split-Inteine
Histon-Modifikation mit Inteinen
Irene Doering
Der Histon-Code ist eine harte Nuss für die Epigenetiker. Split-Inteine helfen ihn zu knacken.
Beim trans-Spleißen von Proteinen durch Split-Inteine verbinden sich zwei getrennte, inaktive Intein-Hälften (N- und C-terminale Exteine) zu einem Intein. Dieses aktive Intein schneidet sich selbst aus dem Fusions-Protein heraus und verknüpft die N- und C-terminalen Exteine miteinander. Mit dieser Technik reinigten Forscher bisher zum Beispiel Proteine oder stellten zyklische Proteine her (siehe hierzu auch Laborjournal 12/2014, S. 60-61).
Split-Inteine sind aber auch für Epigenetiker interessant: Tom Muir's Gruppe an der Princeton University, USA, entwickelte eine Split-Intein-Technik für die Modifikation von Histonen, die auf der Protein-trans-Splicing (PTS) Reaktion von Split-Inteinen basiert. (David et al., Nature Chemistry, 7, 394-402 sowie Fischle et al., Nature Chemistry 7, 371-73).
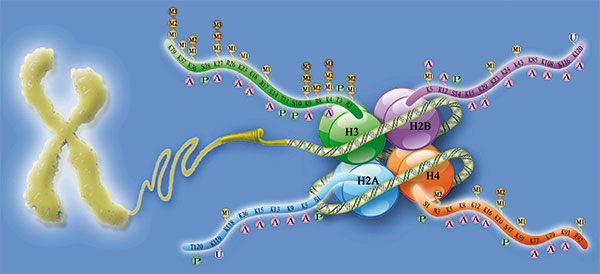
Die spulenförmigen Histon-Proteine, um die sich die DNA beziehungsweise das Chromatin wickelt, sind sehr stark posttranslational modifiziert. Diese Histonmodifikationen, etwa die Acetylierung von Lysin oder die Methylierung von Lysin sowie Arginin, wirken sich auch auf die Funktion des Genoms aus. So verringern sich zum Beispiel durch die Acetylierung die elektrostatischen Wechselwirkungen zwischen den Histonproteinen und der DNA. Die DNA ist dadurch für die Transkriptions-Maschinerie leichter zugänglich und wird verstärkt abgelesen.
Unzählige Modifikationen
Neben Modifikationen, die die Chromatin-Struktur direkt verändern und den Ablauf biologischer Prozesse unmittelbar beeinflussen, gibt es auch indirekt wirkende Modifikationen, etwa Bindestellen für Proteine. Die sogenannte Histon-Code-Hypothese geht davon aus, dass die in unzähligen Kombinationen vorliegenden Modifikationen unterschiedlichste biologische Prozesse beeinflussen. Hierbei auftretende Fehler oder Mutationen stehen deshalb im Verdacht, auch Krankheiten auszulösen.
Histone sorgen also nicht nur für Ordnung auf möglichst engem (Zellkern-)Raum. Sie spielen auch eine essentielle Rolle bei der gesamten Genomfunktion. Kein Wunder also, dass Histonmodifikationen und ihr Einfluss auf das komplexe regulatorische Zellsystem Ziel der Forschung sind.
Da posttranslationale Modifikationen nicht genetisch kodiert sind, muss man ihre Funktion auf biochemischer Ebene dechiffrieren. Die Untersuchung der epigenetischen Mechanismen in einem komplexen Milieu wie dem Zellkern ist jedoch nicht einfach. Bisher versuchten Histonforscher dies auf zwei unterschiedlichen Wegen: Zum einen mit rekonstituierten Systemen oder aber durch Proteomanalysen.
Mit dem ersten, reduktionistischen Ansatz lassen sich zwar Ursache und Wirkung eines individuellen Prozesses nachweisen, das Zusammenspiel mit dem gesamten System bleibt aber weitestgehend im Dunkeln. Der zweite Ansatz liefert eine Fülle systembiologischer Informationen und beweist die Existenz ablaufender Prozesse, gibt aber keine Auskunft über deren Mechanismen.
Verbesserte Spezifität
Chromatinforscher versuchten die Lücke zwischen diesen beiden Strategien zu schließen, in dem sie die Chromatin-modifizierenden Faktoren genetisch oder pharmakologisch manipulierten oder die Histone mutierten. Beide Vorgehensweisen liefern zwar Aussagen zu Chromatin-Modifikationen, sie sind aber sehr unspezifisch.
Hier setzte die Gruppe von Tom Muir an. Ihre PTS-Technik basiert auf „superschnellen” Split-Inteinen (ultra-fast split inteins), die eine sehr hohe Affinität zueinander haben. Die Gruppe aus Princeton modifizierte die superschnellen Split-Inteine und schleuste mit ihrer Hilfe sowohl künstliche als auch endogene posttranslationale Modifikationen sehr präzise und effizient in das Chromatin ein.
Hierzu verknüpften Muir's Mitarbeiter ein Intein-N-Fragment mit einem H2B-Histon (einem der Haupt-Histonproteine) und exprimierten dieses in den Zellen. Das mit einem jeweiligen Marker (zum Beispiel humanes Influenza Hämagglutinin) versehene Intein-C-Fragment synthetisierten sie auf chemischem Weg und schleusten es in die Zellen ein. In der Zelle angekommen, vereinigen sich das markierte Intein-C-Fragment und das Intein-N-Fragment des Histons. Das nun vollständige und hierdurch aktive Intein schneidet sich aus dem Fusionsprotein heraus (Protein-trans-Splicing) und die Molekül-Markierung wird hierdurch an das H2B-Histon gebunden.
Protein-Spleißen in der Zelle
Nach erfolgreich abgeschlossenen In-vitro-Experimenten testete Muir's Team das PTS-Verfahren an intakten Zellen. Um die Aufnahme des markierten Intein-C-Fragments über die Zellmembran zu ermöglichen, die für synthetische Peptide undurchlässig ist, verknüpften sie dieses über eine Disulfidbindung mit einer Zellwand-penetrierenden Peptidsequenz (cell-penetrating peptide sequence, CCPS). Diese vermittelt die Endozytose des Intein-C-Fragments in die Zelle. Im reduzierenden Milieu des Zytosols wird die Disulfidbindung gespalten, das markierte Intein-C-Fragment liegt also wieder in der ursprünglichen Form vor. Der PTS-Spleißvorgang läuft anschließend wie oben beschrieben ab. Experimente mit fluoreszenzmarkierten Intein-C-Fragmenten bestätigten Muir's Gruppe, dass die Markierung nahezu vollständig mit den Histonen umgesetzt wurde und die gewünschte Modifikation stattfand.
Ausgehend von diesen vielversprechenden Ergebnissen verwendetete die amerikanische Gruppe die PTS-Technik schließlich auch, um verschiedene Chromatin-Stadien direkt im Zellkern (in nucleo) zu untersuchen. Hier stellte sich die Frage, ob lokale Variationen der Chromatinstruktur die Vereinigung der beiden Intein-Hälften behindern. Die Experimente der Gruppe belegen jedoch, dass die PTS-Methode auch in isolierten Zellkernen zu den gewünschten posttranslationalen Modifikationen an den Histonen führt.
Um herauszufinden, wie die Chromatinmodifikation mit der PTS-Reaktion von der Konzentration der Reaktionspartner und der Zeit abhängt, reduzierten Muir und Co. schrittweise die Menge des gelabelten Intein-Fragments. Zudem variierten sie die Reaktionszeit. Bei diesen Versuchen stellte die Gruppe fest, dass in euchromatischen Regionen mehr Modifikationen auftraten als in heterochromatischen. Offensichtlich sind euchromatische Chromatin-Abschnitte leichter für die PTS-Reaktion zugänglich als heterochromatische. Mit der PTS-Technik lassen sich also auch Veränderungen der Chromatin-Struktur während des Zellzyklus untersuchen.
Die bisherigen PTS-Experimente führte das Team mit künstlichen Modifikationen durch, etwa Fluorophoren. Aber eignet sich die PTS-Methode auch dazu, endogene posttranslationale Modifikationen in Histone einzuführen, um deren Wirkung im physiologischen Umfeld zu erforschen?
Um hierauf eine Antwort zu finden, wählte die Gruppe eine Modifikation, die großen Einfluss auf die Transkription hat: die Ubiquitinierung von Lysin-120 im H2B-Histon. Zudem wollte sie ausloten, in wie weit Größe und Komplexität der Modifikation der PTS-Methode Grenzen setzt. Die entsprechenden Experimente führten Muir und Co. erneut in isolierten Zellkernen durch. Das Ergebnis dieser Versuchsreihe ist eindeutig: selbst die Ubiquitinierung der Histone ist mittels PTS-Verfahren möglich. Das modifizierte, semisynthetische Chromatin blieb voll funktionsfähig und induzierte die Signalübertragung im Zellkern.
Spurenlose Reaktion
Das mit der PTS-Technik modifizierte Chromatin ist für eine Vielzahl weiterer Experimente geeignet, etwa um biochemische Signalwege oder die Zugänglichkeit des Chromatins zu trans-agierenden Faktoren zu erforschen. Da die PTS-Reaktion keine Spuren hinterlässt (das Intein wird von dem gelabelten Produkt entfernt) verbleibt kein störender Hintergrund in der Zelle. Hierdurch erhöht sich sowohl die Aussagekraft als auch die Spezifität von biochemischen oder massenspektrometrischen Analysen, die mit den modifizierten Histonen durchgeführt werden.
Muir's PTS-Technik ergänzt und vervollständigt somit die bestehenden Methoden der Chromatin-Analyse. Zugleich eröffnet sie aber auch neue Wege zu detaillierten Untersuchungen epigenetischer Prozesse.
Letzte Änderungen: 02.06.2015